驯鹿生物,何时迎来企业、产品“双上市”?
日前,驯鹿生物启动科创板上市辅导。易企说注意到,其官网显示,原首席执行官汪文博士已调任为执行总裁,创始人张金华女士现任董事长兼首席执行官。这一组织架构的变动或是在为上市做充分准备。

图源:驯鹿生物官网
另外一边,据业内人士透露,今年BCMA靶点的CAR-T产品至少会获批一个。纵观已获国家药监局正式受理的相关上市申请,驯鹿生物是极具竞争力的“候选者”之一。
2021年9月,在驯鹿生物获1.08亿C轮融资的融资发布会上,彼时担任CEO兼CMO的汪文公布了3到5年上市的计划。如今,“公司启动IPO+首个产品商业化在即”,驯鹿生物正走在企业和产品“双上市”的关口。
6年之间,1串“人才链”和4次融资
2017年3月,张金华创办驯鹿生物。此前,她主要从事医疗大健康领域的投资和跨境并购业务、国内上市公司并购重组顾问及投资业务。据悉,张金华主导过几十家中国企业的上市和并购重组项目,包括国内A股改制上市、香港上市、美国纳斯达克上市、加拿大多伦多交易所上市项目,并在多个项目同时兼任财务顾问和律师双重身份。
2018年1月,胡广博士加入驯鹿生物,现任研发副总裁。胡广自2015年回国开始了CAR-T产品研发工作。加入驯鹿生物前,他曾任赛诺亚生物总经理,北大工学院绍兴研究院所长。据悉,驯鹿生物头几年,正是胡广主持了一系列CAR-T研发工作。
2020年10月,汪文博士出任首席医学官(CMO)。官网显示,汪文具有深厚的医学背景,拥有五年外科住院医师、主治医师临床经验;曾在西比曼、药明巨诺、先声药业担任医学总监、临床开发高级总监、临床科学执行总监。汪文自2006年起从事细胞治疗工作,作为项目主要成员成功申报中国第一个靶向CD19的CAR-T临床试验。加入驯鹿生物后,汪文带领临床开发团队快速推进CT103A临床试验项目,这也是驯鹿生物对外披露的近10个管线中进展最为迅速的候选产品。同期,资深免疫学家郑彪博士出任驯鹿生物首席科学官,负责公司整体产品战略布局的制定和推进管线产品的研发工作。目前,郑彪已加入邦耀生物担任首席执行官。
2022年2月,丛征宇加入驯鹿生物担任综合管理部高级副总裁。他曾先后担任默沙东中国供应链负责人、杜邦亚太区精益生产导师、诺华原料药供应链负责人、勃林格殷格翰大中华供应链负责人、复星凯特供应链副总裁,拥有15年医药供应链管理和11年运营管理工作经验,在化药和细胞治疗供应链管理、世界级供应链体系建设、生产型企业精益生产体系方面拥有深厚的理论和实践经验……
仔细梳理就不难发现,驯鹿生物在短短6年间,可以从两三人的团队逐渐壮大成为国内细胞免疫治疗研发及产业化第一梯队,重要原因之一就是经验老道的医疗市场“操盘手”在公司发展的每个阶段都找到了最恰如其分的团队合作伙伴。张金华曾公开表示,公司的核心团队,都与自己在创业前期有过很多合作。当走到同一个平台上共同创业的时候,他们也把各自多年来的合作伙伴带到公司里来。“有的是以全职的方式加入,有的是以顾问的方式加入。” “走进我们公司就会发现,我们不像传统的生物研发企业,更像一个互联网公司风格。”
这支团队让驯鹿生物在6年中获得了4轮融资。天眼查信息显示,驯鹿生物于2018年3月29日完成A轮6000万人民币融资。
2020年3月,驯鹿生物获得高瓴创投B轮独家投资6000万美金,此轮融资主要用于丰富产品管线,推进当前项目的进度(包括中美双报和临床试验开展),提升全人源抗体开发平台技术,扩大与国际领先研发机构的合作,加快商业化设施的建设等。
值得注意的是,彼时高瓴创投刚刚官宣成立一个月。2020年2月,高瓴资本发布“致创业者的一封信”,宣布以百亿规模成立专注投资早期创业公司的高瓴创投,后者将共享高瓴资本丰富的投后管理资源。驯鹿生物为高瓴创投成立以来投资的首个公司。
2021年8月,驯鹿生物完成1.08亿美元C轮融资。本轮融资由鼎晖百孚领投,建银国际作为主要投资方参与,光大控股、基石资本、信银投资、Plaisance Capital跟投,高瓴创投持续加投。
2023年1月,驯鹿生物完成近5亿元人民币C1轮融资,此轮融资由国鑫投资、倚锋资本、上海外高桥集团、浦东投资控股、南京江北国资、厚新健投、宏诚投资等11家投资机构共同参与,多家地方/国有资本的加入尤为惹眼。
至此,启动科创板上市辅导前,参投驯鹿生物的机构种类愈加丰富起来。
不止于血液瘤
IPO提上日程之后,管线布局有无竞争力是接下来这一进程能否顺利的关键因素之一。从官网公布的研发管线来看,驯鹿生物现有9款在研产品处于不同研发阶段,涉及细胞治疗药物和抗体药物。
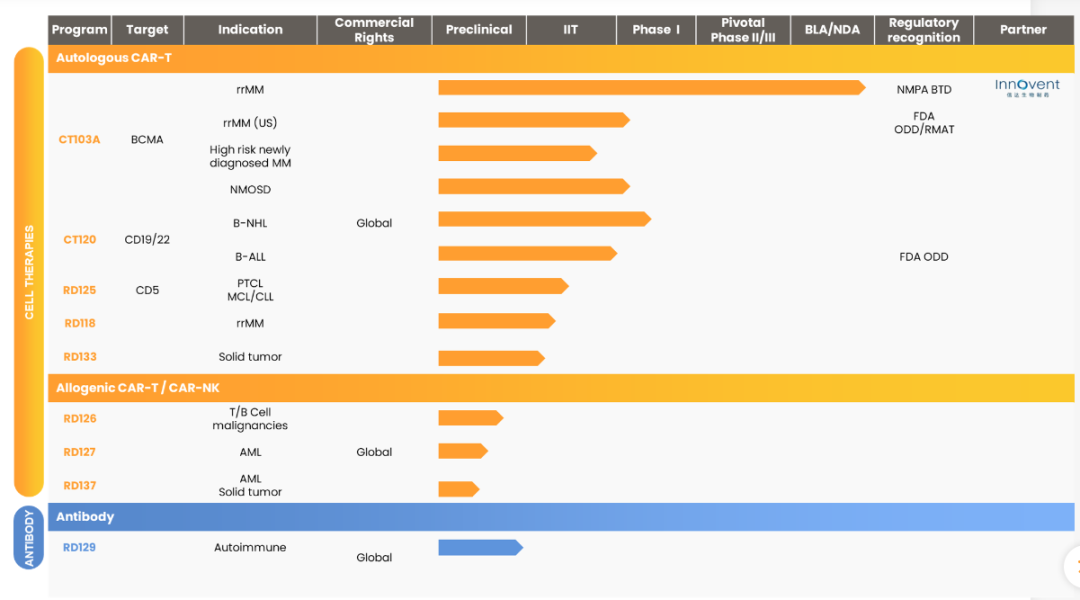
图源:驯鹿生物官网
从进展最为迅速的产品谈起,驯鹿生物全人源BCMA嵌合抗原受体自体T细胞(CAR-T)注射液CT103A(伊基仑赛)上市申请已获国家药监局正式受理,并纳入优先审评资格。全球化方面,CT103A已获得FDA批准注册临床,用于治疗复发/难治多发性骨髓瘤,该产品被NMPA纳入“突破性治疗药物”品种,并先后获FDA授予孤儿药认定、再生医学先进疗法(RMAT)和快速通道资格。
另外,伊基仑赛新增扩展适应症抗体介导的视神经脊髓炎谱系疾病的临床试验申请已获国家药监局批准,这是全球首个CAR-T产品在该疾病领域的临床试验申请。“CAR-T细胞疗法在恶性肿瘤领域的应用已经被广为接受,但在自体免疫性疾病这一仅次于肿瘤领域的第二大药物市场中的应用却鲜有报道。”汪文曾在受访时表示,驯鹿生物是国际上最早把CAR-T细胞疗法应用于自免领域的企业之一,在中国递交了第一个CAR-T细胞疗法治疗自免疾病的IND,标志着CAR-T细胞疗法从恶性肿瘤领域向自免领域拓展的开始,对于细胞治疗行业具有重要意义,同时通过BCMA-CAR-T细胞疗法把浆细胞清除为浆细胞产生的自身抗体导致的一大类自免疾病提供了新的治疗策略。
去年10月,驯鹿生物和细胞疗法企业Cabaletta Bio宣布就CD19序列达成全球独家许可协议——驯鹿生物授予Cabaletta其经临床验证的全人源CD19序列的全球独家开发、生产及商业化权利,应用于Cabaletta在自身免疫性疾病领域开发修饰T细胞的产品(CABA-201)中。今年4月初,Cabaletta Bio宣布,CABA-201的研究性新药申请已获得FDA批准,以启动CABA-201的1/2期临床试验,用于治疗活动性狼疮肾炎或无肾脏受累的活动性系统性红斑狼疮(SLE,一种严重的自身免疫性疾病)。
4月7日,CDE 官网显示,药明巨诺的CD19靶向CAR-T细胞疗法瑞基奥仑赛一项新适应症获批临床,用于治疗中重度难治性系统性红斑狼疮。这意味着瑞基奥仑赛在血液瘤之外,也开始布局市场更加广阔的自身免疫领域。
除伊基仑赛外,驯鹿生物自主研发的创新候选产品CT120(全人源CD19/CD22双靶点CAR-T细胞注射液)也已进入临床研究阶段,适应症分别为CD19/CD22阳性的复发/难治B细胞非霍奇金淋巴瘤和复发/难治急性B淋巴细胞白血病,并已获得FDA授予孤儿药认定;全人源双表位靶向CD5的CAR-T产品CT125具有“first-in-class”潜力。截至目前,全球范围内获批的CAR-T均为单靶点产品,很多患者治疗后会出现复发的现象,而开发双靶点的CAR-T产品有望解决这一难题。
上述三款创新产品的临床开发,意味着驯鹿生物的细胞免疫治疗产品管线做到在浆细胞、B细胞和T细胞恶性肿瘤领域的全覆盖,这在中国细胞治疗医药企业中并不多见。
据悉,驯鹿生物拥有近10000㎡的南京商业化生产基地,并获得CAR-T细胞治疗产品《药品生产许可证》,将用于伊基仑赛上市后的生产。一般来说,企业上市辅导期为3-12个月。驯鹿医药,何时迎来企业、产品“双上市”?或许,就在今年?
参考资料:
成立仅6年,高瓴创投首投企业启动IPO
驯鹿生物伊基仑赛注射液新增自身免疫性疾病适应症IND申请获受理
全球第5款自免CAR-T细胞疗法挺进临床,驯鹿生物拥有商业权益

