国产PD-(L)1“四小龙”排名洗牌,康方领跑第二梯队,出海航线转向
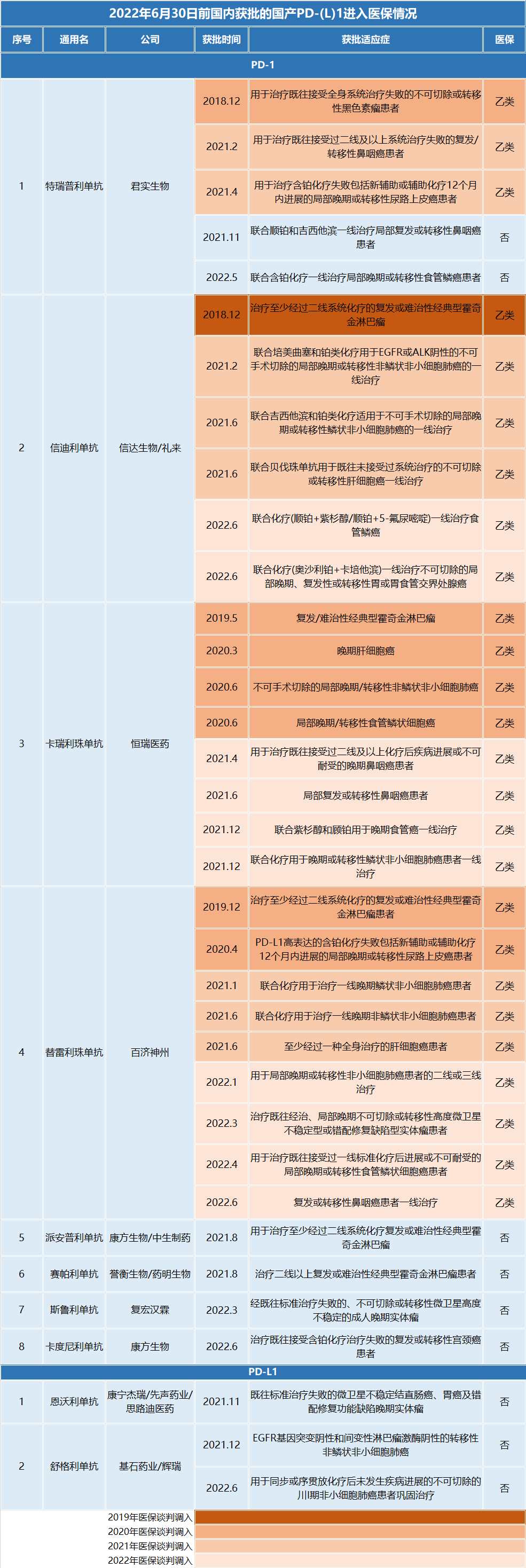
作为国产创新药最卷赛道,国内已有十六款PD-(L)1产品获批,其中包括10款PD-1单抗(8款国产,2款进口),5款PD-L1单抗(3款国产,2款进口)以及 1款 PD-1/CTLA-4 双抗(国产)。国产分别涉及恒瑞医药、百济神州、君实生物、信达生物、康方生物、誉衡药业、复宏汉霖、康宁杰瑞、基石药业、乐普生物等上市企业。
目前,国产PD-(L)1企业2022年财报陆续发布——
国产PD-(L)1销售额
“四小龙”市场份额排名洗牌,康方生物领跑第二梯队
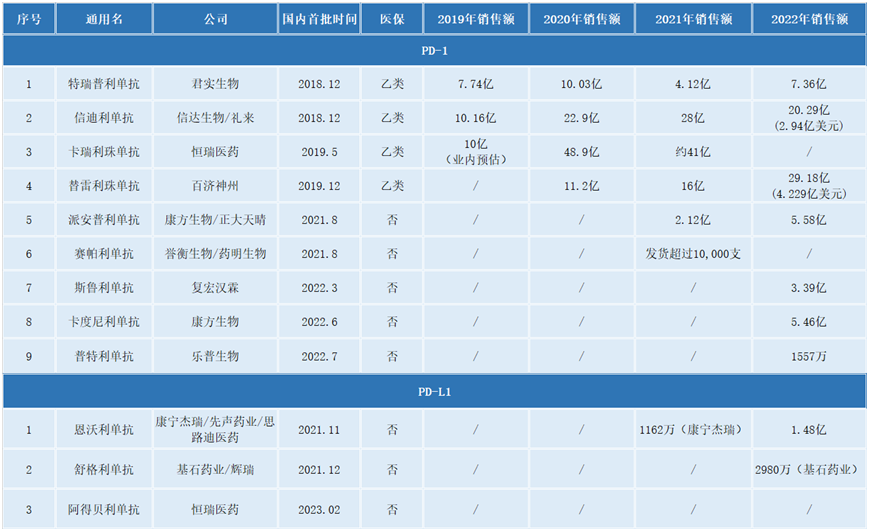
梳理发现,国产PD-(L)1产品从2019年才开始陆续进入商业化。从近年来的销售业绩来看,虽然卡瑞利珠单抗获批时间较晚,但是恒瑞医药作为老牌药企依靠着建立起的成熟销售团队,该产品业绩长期遥遥领先。
在各家药企的财报中,恒瑞医药一如既往对PD-1单抗卡瑞利珠单抗业绩保持神秘。根据PDB更新的数据,2022年恒瑞医药的卡瑞利珠市场份额缩水,并滑至第二的位置,取而代之的是百济神州的替雷利珠单抗。
百济神州的替雷利珠单抗全年收入达到29.18亿元,业绩突飞猛进。相较于2021年16亿元的收入高涨82.38%。
久居第二的信达生物的信迪利单抗2022年全年业绩20.29亿元,业绩出现下滑。
而君实生物的这款国内首款PD-1单抗特瑞普利单抗,由于早期布局策略集中于小适应症,销售业绩未保持先发优势,长期落后于其他第一梯队产品。但随着适应症的扩大,在“内卷”的激烈竞争中,2022年全年7.36亿元的成绩较上一年度全年4.12亿元成绩有着显著提升。
“四小龙”2022年全年揽收国内PD-1市场份额不足86.01亿元,相比于2021年逼近90亿元的市场份额而言,有些许缩水。而2020年,这四款产品的市场份额达到93亿元。尽管如此,国内的PD-1的绝大部分市场份额依旧被四款产品霸占。
不过,后入局者亦有表现优异、业绩强劲者。
国产第五款PD-1产品——康方生物的派安普利单抗2021年8月获批上市,在不到半年的时间,销售收入达到2.12亿元,2022年全年也取得了5.58亿元的好成绩。
同样来自康方生物的国产首款PD-1/CTLA-4双抗卡度尼利单抗,作为差异化产品代表,2022年6月获批上市,在下半年取得了5.46亿元的收入。
凭借这两款产品,康方生物也成为PD-1第二梯队中的最大赢家。
除已获批的产品外,李氏大药厂的首克注利单抗、科伦博泰的泰特利单抗、正大天晴的TQB2450以及嘉和生物的杰洛利单抗也已申报上市。除了这些,目前还有超过70个国产新药在研。PD-(L)1抗体依旧是药企之间竞争最为激烈的市场之一,赛道拥挤程度可想而知。
医保放量“馅饼”成“陷阱”,企业低价竞争或陷入“囚徒困境”
影响PD-(L)1产品业绩的还有一个关键要素——医保。目前国内仅有君实生物、信达生物、恒瑞医药和百济神州的四款PD-1产品进入医保。
2019年,信达生物的信迪利单抗作为“第一个吃螃蟹的人”降价64%成功进入医保目录,年费用由28万元降到9.67万元/年,获得先发优势。2020年1月1日,2019版医保目录正式落地执行,2020年信迪利单抗销售额翻番,超22亿。
2020年,君实生物、恒瑞医药、百济神州的三款PD-1以平均78%的降幅全部纳入医保,年治疗费用直接降到5万元/年。然而,竞争对手的入局,将激烈竞争拓展到医保目录内部。2021年3月1日起开始执行医保谈判价格,新入医保的恒瑞医药、君实生物的PD-1销售成绩并未展示出医保放量的优势,反而出现严重下滑。
对此,恒瑞医药坦言,卡瑞利珠单抗价格降幅达85%,加上产品进院难、各地医保执行时间不一等诸多情况,造成卡瑞利珠单抗销售收入同比下降;君实生物则表示是因为销售团队频繁调整,以及特瑞普利单抗仅有小适应症纳入医保目录,2021年销量虽然有所提升,但未能实现“以价换量”等因素而导致其PD-1销售收入出现负增长。
2022年1月1日落地执行的2021版医保目录中,信达生物、百济神州和君实生物的PD-1产品新增适应症分别以62%、33%、8.9%的降幅进入。恒瑞医药放弃新增适应症进入医保目录的机会,而2022年恒瑞医药PD-1业绩的大幅缩减或许与此相关。此外,首个进入医保目录的信迪利单抗的先发优势地位不保,首次出现下滑。
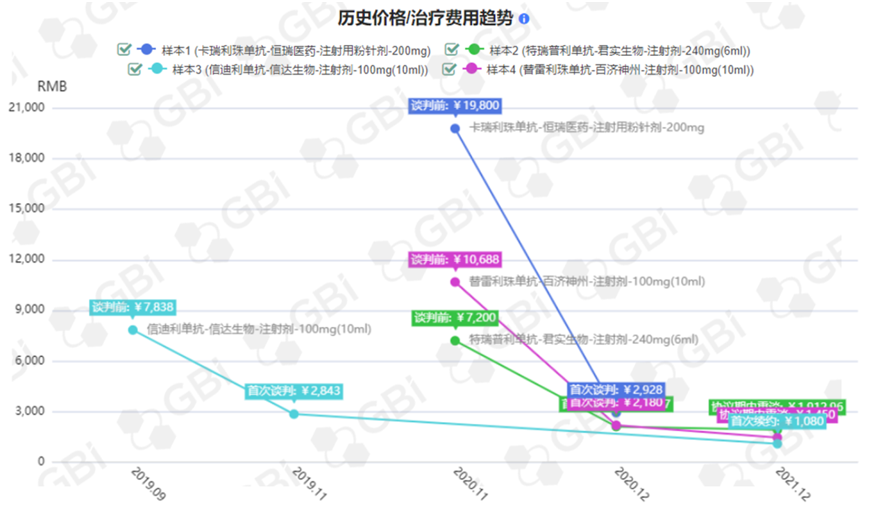
2019年-2022年国产PD-1医保降价趋势 图源:GBIHealth
在2022年的医保谈判中,最新获批且能够参与谈判的6款PD-(L)1,三款放弃谈判,三款谈判失败。“四小龙”参加目录内品种新增适应症的谈判。(文末附2022年6月30日前国产PD-(L)1进医保情况表)
BCG数据显示,默沙东的“K药”和百时美施贵宝的“O药”在美国的年治疗费用(人)分别为17.5万美元和14.9万美元,在中国的年治疗费用(人)分别为2.1万美元和1.6万美元,而国内PD-1四小龙的年治疗费用(人)远低于这一金额,其中信达生物的PD-1药物在国内的年治疗费用(人)仅为0.5万美元,是K药在美国市场年治疗费用(人)的1/35。
在国内PD-(L)1赛道“内卷”日趋严重的情况下,价格战必不可免。在医保谈判的“重拳”之下,降价趋势更加凶猛。另一方面,随着更多的竞品进入医保,市场空间的有限性使得医保放量的优势被削弱。而低价竞争的策略恐令企业陷入“囚徒困境”。因此,以PD-1为首内卷严重的靶点的国产创新药很难实现国外市场创新药的市场规模的典型。
变脸的FDA与国产PD-(L)出海航线的转变
伴随着赛道的内卷化,以及医保降价的带来的销售压力,国内PD-(L)1可扩展市场空间收窄,海外市场不可或缺,PD-(L)1药企大举进攻海外市场。
最早在2018年,FDA肿瘤卓越中心主任Richard Pazdur曾到访中国,那时他还明确地“鼓励”中国公司将PD-1/PD-L1带入美国市场,与跨国大药企竞争来降低美国高昂的药品价格。“只要质量好,FDA一定会接受仅依靠中国临床数据的申请。”他当时这样说道。
在FDA如此明确的鼓励态度之下,国产Biotech公司和跨国药企蠢蠢欲动,接连展开合作,积极布局起了国产创新药在美国的市场。其中,信达生物牵手礼来、基石药业与EQRx达成合作;百济神州与诺华签订合作协议,君实生物与Coherus联盟……
然而,在去年年初,Richard Pazdur却公开表示国际多中心临床试验,而非单一国家数据,才是横跨全球药物开发和监管协调的桥梁,并将自己2019年鼓励中国数据PD-1来美国申报的表态称作“可能被利用的监管漏洞”。
FDA的变脸直接导致了信达生物信迪利单抗所面临的挫折——
北京时间2022年2月11日凌晨,信达生物的信迪利单抗迎来了美国食品药品监督管理局肿瘤药物咨询委员会的审评会议(ODAC)讨论,建议信达生物补充额外的临床试验,以证明信迪利单抗在美国人群和美国医疗实践中的适用性。
这是国产PD-1首次直面ODAC,因此备受关注。而这一挫折也为后面的企业敲响了警钟,包括国内Biotech和与之牵手的跨国药企。
诺华在2022年Q3业绩中表示放弃在美国递交替雷利珠单抗一线治疗鼻咽癌适应症的上市申请。礼来甚至直接表示放弃信迪利单抗在中国以外的权益。前不久,基石药业的PD-1和PD-(L)1也被合作伙伴EQRx放弃。
君实生物的PD-1在去年的审评遭到FDA两次延期。不过,据Coherus一季度报显示,FDA已通知该公司,计划于2023年5月晚些时候对特瑞普利单抗生产设施进行必要的检查。Coherus预计,特瑞普利单抗将于2023年第三季度在美国获得FDA的批准和商业上市。
尽管,遭受了FDA变脸带来的挫折,国产PD-(L)1“走出去”的步伐却不会因此停滞。现如今,已有多家PD-(L)1企业转身奔赴欧洲及东南亚市场。
百济神州的替雷利珠单抗在欧盟、英国、澳大利亚等地的上市申请均已受理;君实生物特瑞普利单抗两个适应症和基石药业舒格利单抗的上市申请也在欧盟和英国的上市许可申请获得受理;康方生物PD-1出海东南亚11个国家……
可以看到作为广谱抗癌药的“万金油”PD-(L)1受到了国内药企的追捧,其掘金之路也在不断拓展。无论是先发者还是后来者,都在提前做规划,找到PD-(L)1的下一个发力点。这还不仅仅是向海外市场的拓展,还包括适应症,与化疗、靶向药物以及其他免疫调节剂探索联合疗法。当下最火的ADC产品也成为PD-(L)1联用的热门种类,像K药、T药等进口PD-(L)1产品甚至还在探索与mRNA肿瘤疫苗的结合。
附件