红日高管违规减持丨复星高管辞职丨恒瑞、扬子江吉非替尼获批
红日医药发布高管违规减持公告
红日医药6月4日发布公告,称接到副总经理高国伟通知,因其家属操作其证券账户卖出其持有的部分公司股票,导致其违规减持公司股份。
公告称,高国伟和其家属两人开户在同一个证券公司,证券账户相差一个数字,2020年6月3日其家属在未通知其本人的情况下误进入其证券账户,使用证券交易系统以集中竞价方式减持公司股份10万股,交易均价为5.5元/股,减持成交金额为55万元。高国伟先生本次减持公司股份的数量占其所持公司股份的2.3585%,占公司股本总额的0.0033%。
红日药业表示,高国伟在知悉上述违规减持股份行为后,及时上报公司,并由公司证券部向监管机构报备。经核查,高国伟本次减持股份不处于窗口期,也未构成短线交易,不存在其他应披露未披露事项,也不存在利用内幕信息交易的情形。高国伟发表致歉声明,同时承诺自公告披露之日起12个月内不减持公司股份。
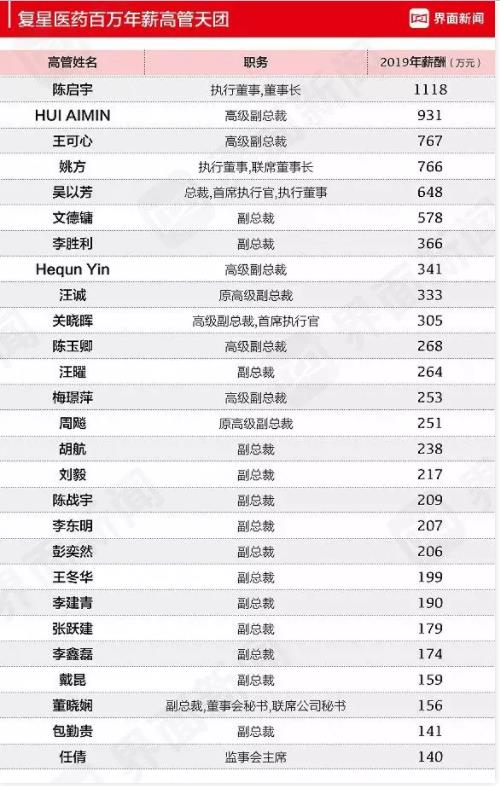
上海复星高管辞职
上海复星医药6月1日发布公告,公司高管李建青因个人原因辞去副总裁职务。

此前,戴昆4月17日辞去副总裁职务,Hequn Yin于5月6日辞去高级副总裁职务。


据界面新闻统计,2019年复星医药有27位年薪百万的高管。其中,李建青薪酬为190万,戴昆薪酬159万,Hequn Yin薪酬341万。
江苏恒瑞、扬子江吉非替尼获批
6月1日,江苏恒瑞与扬子江药业获批吉非替尼上市批号。截至目前,除原研厂家阿斯利康外,国内已有齐鲁、正大天晴、湖南科伦获批上市,同时,另有江苏天士力等6家企业正在申报生产。
浙江华海左乙拉西坦缓释片获批
6月1日,浙江华海的左乙拉西坦缓释片获药品批准文号。
公告称,浙江华海于2015年5月获FDA通知,向FDA申报的左乙拉西坦缓释片新药简略申请获得批准;2018年6月,向国家药监局药品审评中心递交的注册申请获得受理。2018年8月,药监局药物审评中心发布《拟纳入优先审评程序药品注册申请的公示(第三十一批)》,将左乙拉西坦缓释片纳入优先审评药品注册程序并公示;近日,收到国家药监局核准并签发的左乙拉西坦缓释片《药品注册批件》。
左乙拉西坦缓释片主要用于治疗癫痫,由UCB INC研发,于2008年9月获FDA批准。左乙拉西坦缓释片全球主要生产厂商有ACTAVIS LABS FL INC,APOTEX INC ,TEVA PHARMS等,国内生产厂商为深圳信立泰药业。据统计,2019 年左乙拉西坦制剂全球市场销售额约 21.866 亿美元,国内左乙拉西坦片(不包括缓释片)全国等级医院销售额约人民币 8.87 亿元。
上海医药SPH4336片将启动Ⅰ期临床
上海医药6月2日发布公告,该集团及其全资子公司开发的SPH4336片收到国家药监局核准签发的《临床试验通知书》,并将于近期启动Ⅰ期临床试验。
临床前研究表明该项目具有更优的体内外抗肿瘤活性和更好的安全性,拟用于晚期 2 实体瘤的治疗。SPH4336 片于2015年3月启动立项2019年10月完成临床前研究,其后向国家药监局提交临床试验申请,并于2020 年3月2 日获得国家药监局受理。截至目前,该项目已累计投入研发费用约 4,650.47 万元人民币。目前,与该项目同靶点的药品已于全球上市,2019年同靶点的药品全球销售总额为 60.27 亿美元。

