收获期盘点:全球获批的13款双抗药物梳理
双特异性抗体(Bispecific Antibody,BsAb,简称双抗)是指能同时特异性结合两个抗原或抗原表位的人工抗体,2009年全球首款双抗药物卡妥索单抗获批上市,但是由于表现不佳后又于2017年退市。
前几十年,由于技术限制,双抗发展缓慢,直到2014年FDA才批准了全球第二款双抗药物博纳吐单抗上市,不过随着技术的成熟,双抗得到快速发展,近几年多款药物获批上市,截止到2023年9月份,全球已获批13款双抗药物(包括已退市的),从2022年初到现在就获批了9款药物(图1)。
获批的双抗药物涉及的靶点多样,包括CD3、CD19、EGFR、cMET、PD-1、CTLA-4和BCMA等,探索的适应症包括血液瘤、多发性骨髓瘤、血友病和非小细胞肺癌等。

图1. 获批上市的双抗药物
1.卡妥索单抗(Catumaxomab)
卡妥索单抗是首款获批的靶向CD3和EpCAM的双特异性抗体,是一种三单抗(Triomab)形式,其含有大鼠和小鼠来源的IgG2半抗体。卡妥索单抗的小鼠/大鼠Fc部分通过NK细胞和其他细胞方式诱导FcγR介导的细胞毒性(图2)[1]。
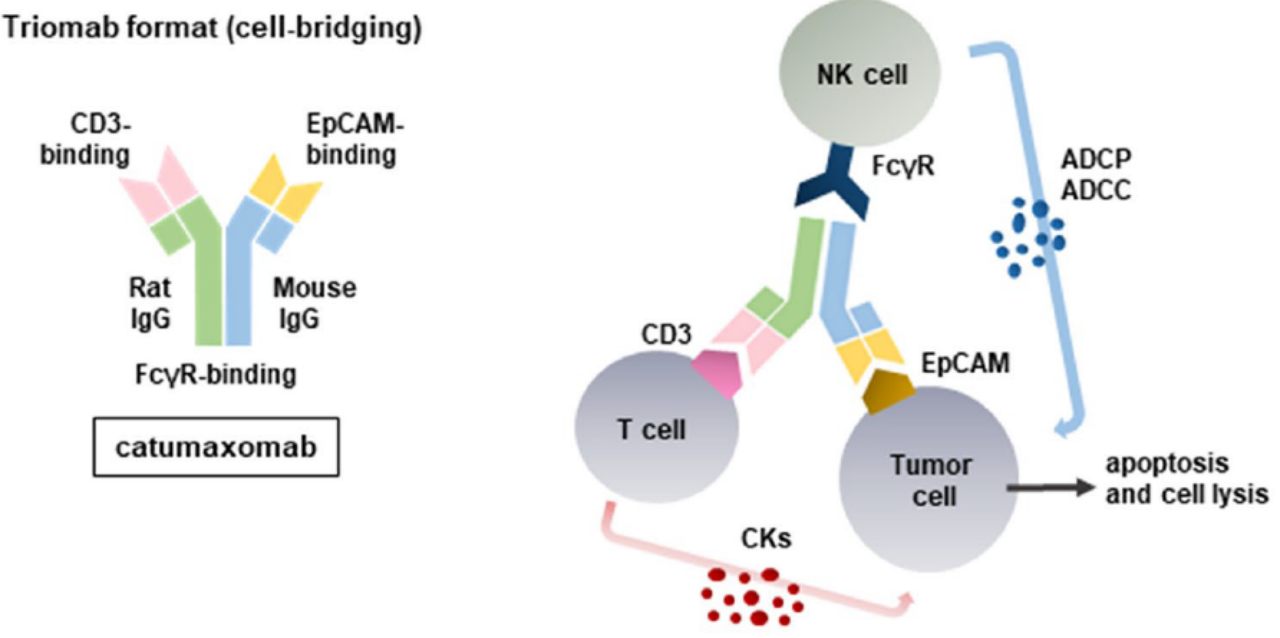
图2. 卡妥索单抗结构与作用模式
卡妥索单抗于2009年获得欧盟(EMA)批准上市,但是由于上市后表现欠佳,卡妥索单抗于2017年退市停产。
但是凌腾医药重启了卡妥索单抗在国内的开发。2020年7月,卡妥索单抗开展了伴腹膜转移胃癌的国际多中心三期临床试验,2021年4月,卡妥索双抗获得国家药品监督管理局批准的一项用于治疗非肌层浸润性膀胱癌(NMIBC)的1/2期( NCT04799847)的临床试验许可,去年Lindis Biotech 在14届欧洲泌尿系统癌症多学科大会(EMUC)上公布了卡妥索单抗CATUNIBLA临床试验最新结果:卡妥索单抗在NMIBC中显示良好的安全性和初步疗效。
2. 博纳吐单抗(Blinatumomab)
博纳吐单抗是由安进研发的全球首个CD19-CD3双特异性T细胞接合器(BiTE)药物,由两个主要片段抗CD3 scFv(VL-VH)和抗CD19 scFv(VL-VH)组成,于2014年12月3日获FDA批准上市,用于治疗复发的费城染色体阴性的B细胞急性淋巴性白血病(ALL)。
Zhou等人报道了博纳吐单抗在中国成人 Ph 阴性复发/难治性B细胞前体急性淋巴细胞白血病的有效性和安全性,博纳吐单抗2个周期内的CR/CRh率为45.6%,中位总生存期为9.2个月,中位无复发生存期为4.3个月(图3)[2]。
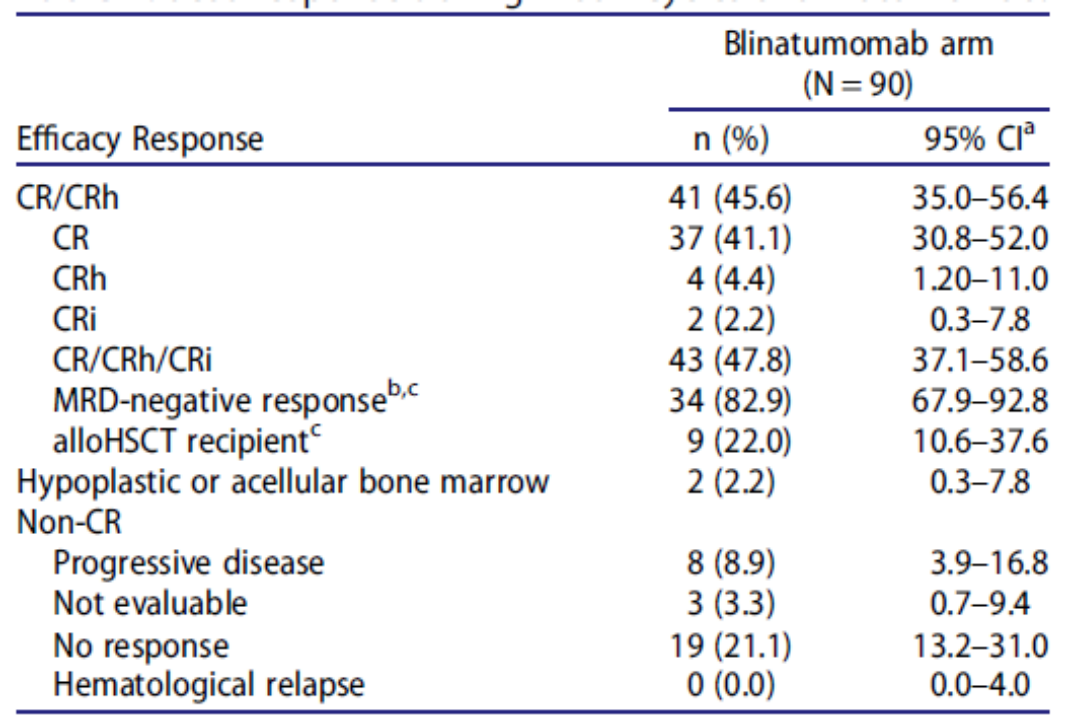
图3. 博纳吐单抗的临床疗效
博纳吐单抗自上市后销售额稳步增长,2021年达到4.72亿美元,然而可能由于博纳吐单抗半衰期仅 2 小时,患者需要频繁给药,以及其它药物的竞争导致销售额在2022年下滑至3.36亿美元(图4)。
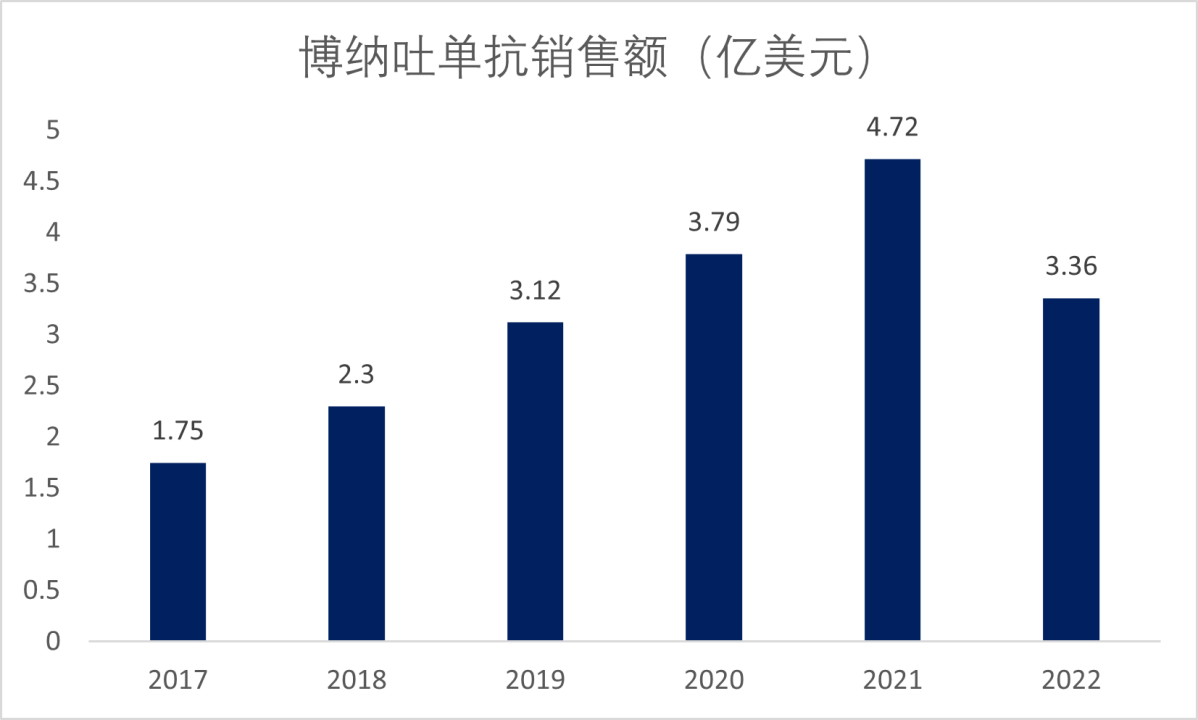
图4. 博纳吐单抗销售额
3.艾美赛珠单抗(Emicizumab)
艾美赛珠单抗是一种双特异性单克隆抗体,可桥接活化的 IX 因子和 X 因子以替换缺失的活化因子 VIII 的功能,从而恢复止血。
艾美赛珠单抗于2017年11月首次被FDA批准上市并于2018年被FDA扩增新适应症,用于含或不含Ⅷ因子抑制物的A型血友病出血预防治疗。
艾美赛珠单抗在临床上开展一系列HAVEN 试验,包括HAVEN 1-6。2018年HAVEN 3试验结果被发表在新英格兰医学杂志上,HAVEN 3试验是一项研究艾美赛珠单抗对不含因子VIII抑制剂的A型血友病患者的预防作用的3期多中心试验[3]。
研究结果表明:皮下注射每周一次或每 2 周一次艾美赛珠单抗预防导致在血友病 A 患者中,出血率显著低于对照组,超过一半的接受预防的受试者没有治疗出血事件。
基于HAVEN 3-5这三项关键性3期临床试验,艾美赛珠单抗在国内斩获新适应症,成为目前中国首个且目前唯一一款可同时治疗体内含或不含凝血因子VIII抑制物的A型血友病常规预防性药物。
HAVEN 6研究纳入人群为经医生评估需要进行预防治疗的、不存在FVIII抑制物的轻型和中间型血友病A患者。基于HAVEN 6 试验积极的结果,欧盟委员会于2023年02月01日批准延长艾美赛珠单抗在欧盟的上市许可(MA),将中度血友病A患者包括在内。
艾美赛珠单抗自2017年上市后的年复合增速超过 300%,并于2020年成功突破20亿美元销售额大关,成为重磅品种,主要是由于艾美赛珠单抗相比血友病传统疗法在给药便利性和疗效上均有所提升所致。2021年,艾美赛珠单抗全球销售额同比增长41%至30.88亿瑞士法郎,2022年艾美赛珠单抗销售额同比增加27%达到38.23亿瑞士法郎,今年上半年销售额达到20.87亿瑞士法郎,持续增长(图5)。
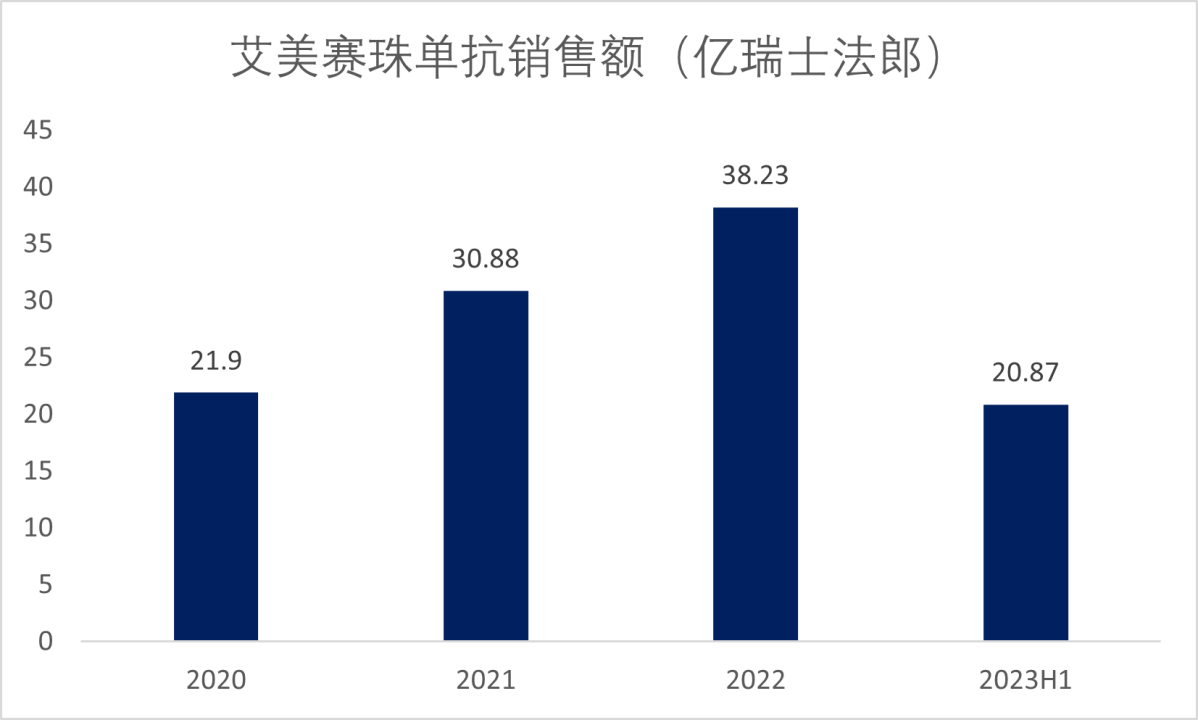
图5. 艾美赛珠单抗的销售额
4.埃万妥单抗(Amivantamab)
埃万妥单抗是由强生制药研发的首款EGFR/c-Met双特异性抗体,具有完整的人IgG1骨架携带Fc的Duobody形式,于2021年5月正式被FDA批准用于EGFR外显子20插入突变的NSCLC成年患者的二线治疗,国内处于临床3期阶段。
埃万妥单抗的一项多中心、开放标签、多队列CHRYSALIS临床实验(NCT02609776)结果显示埃万妥单抗治疗非小细胞肺癌客观缓解率为40%,完全缓解率为3.7%,疾病缓解时间>6个月的患者比例为63%(图6)[4]。
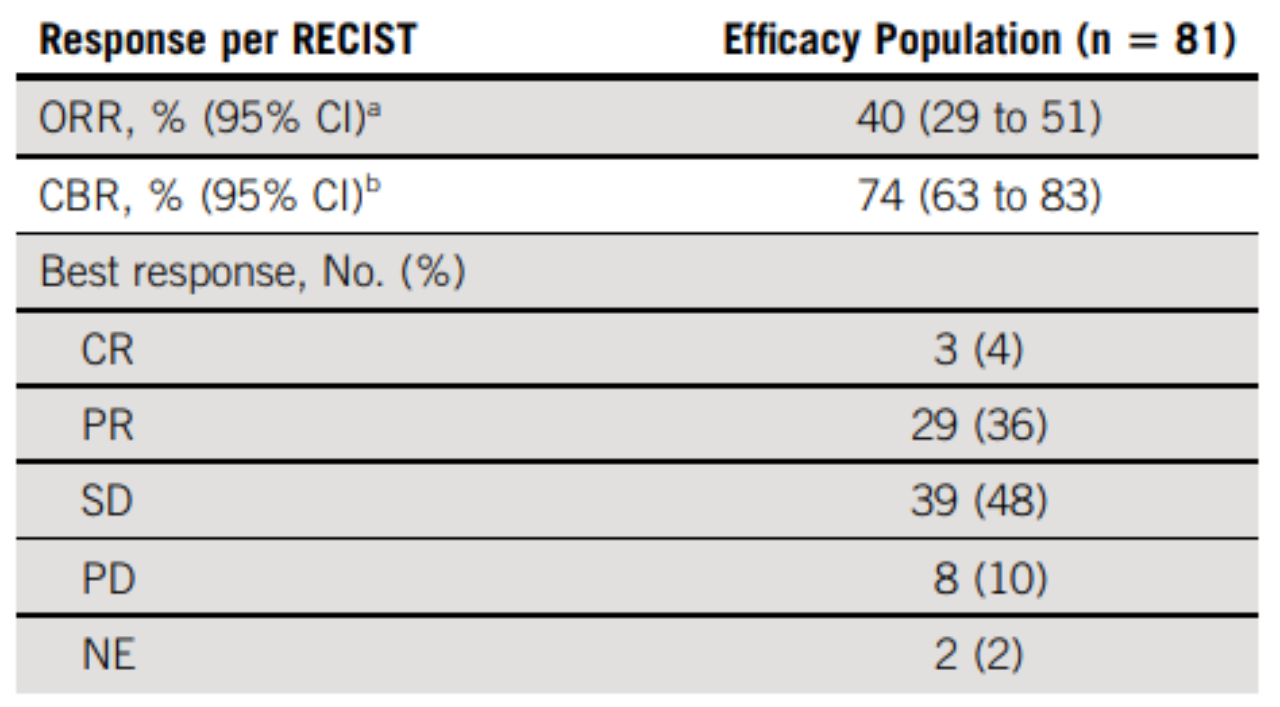
图6. 埃万妥单抗的CHRYSALIS临床实验结果
2022年世界肺癌大会(WCLC)上陆舜教授分享CHRYSALIS研究评估埃万妥单抗+拉泽替尼联合方案的疗效的E队列的结果:截止2022年6月,患者中位随访时间为28个月,中位缓解持续时间(mDOR)及中位无进展生存时间(mPFS)仍未达到,预示着埃万妥单抗联合Lazertinib用于EGFR敏感突变NSCLC一线治疗,mDOR和mPFS将超过28个月。
2023年WCLC上研究者报道埃万妥单抗+拉泽替尼+卡铂+培美曲塞治疗奥希替尼耐药且经多线治疗的晚期NSCLC患者长期随访的最新结果(CHRYSALIS-2):经中位随访13.1个月(2.4-17.5个月),客观缓解率(ORR)为50%。
近期,Byoung等人在Nature Medicine报道了埃万妥单抗和拉泽替尼治疗奥希替尼耐药EGFR突变晚期非小细胞肺癌的1期试验结果(NCT02609776):在一项由45名未选择生物标志物的患者组成的探索性队列中,总体缓解率的为36%。中位缓解持续时间为9.6个月,中位无进展生存期为4.9个月[5]。
5.Tebentafusp-tebn(Kimmtrak)
Tebentafusp是由Immunocore研发的一种首创的双特异性gp100肽-HLA-A*02:01定向T细胞受体(TCR)CD3 T细胞接合剂,Tebentafusp 的 TCR 臂与 HLA-A*02:01 阳性葡萄膜黑色素瘤细胞结合,并通过CD3激活T细胞,释放炎性细胞因子和细胞溶解蛋白,导致肿瘤细胞的直接裂解[6]。
Tebentafusp于2022年1月份获FDA批准用于治疗治疗转移性葡萄膜黑色素瘤(mUM)。Tebentafusp是首个获得FDA批准的TCR疗法,也是首个获得FDA批准治疗不可切除性或转移性mUM的疗法。
Tebentafusp在临床上开展多项试验,探索不同的适应症,包括葡萄膜黑色素瘤、皮肤黑色素瘤和恶性黑色素瘤等(图7)。
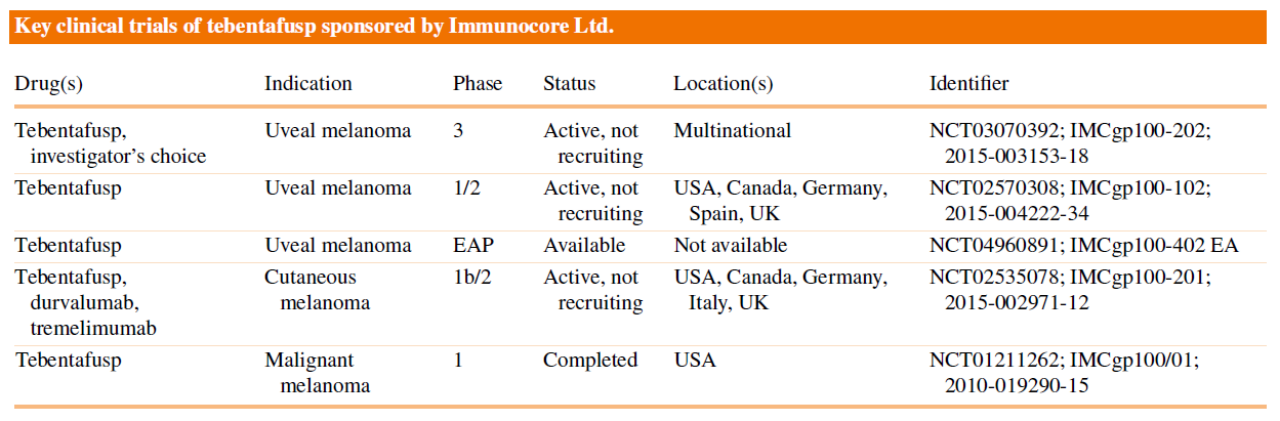
图7. Tebentafusp开展的临床试验
6.Faricimab(Vabysmo)
Faricimab是由罗氏开发的于2022 年 1 月获 FDA 批准上市的靶向VEGF-A/Ang2的双抗眼科药物,它是全球首款获批的双抗眼科药物,后续又陆续在欧洲和日本等近60个国家或地区批准上市,用于治疗湿性年龄相关性黄斑变性(wAMD)和糖尿病黄斑水肿(DME)。
今年5月,Vabysmo申报的新适应症视网膜静脉阻塞(RVO)已获受理,目前Vabysmo已在中国申报3项适应症(去年8月申报的DME和wAMD)。
Vabysmo被FDA批准是基于四项3期临床研究结果,包括TENAYA、LUCERN、YOSEMITE和RHINE。研究结果显示使用Vabysmo实现了稳健的视力增益和解剖学上的改善,可调节每16周给药一次,证明Vabysmo有可能延长治疗糖尿病黄斑水肿患者的持久性。
Vabysmo自上市以来,销售额表现不错,2022年全球销售额达到6.20亿美元,2023年第一季度达到4.86亿美元,同比增长约20倍,2023年上半年销售额高达9.57亿瑞士法郎(10.96亿美元),较去年同比增长超过500%,正在加速放量,预计Vabysmo今年销售额有望达到20亿美元,成为罗氏的重磅产品(图8)[7]。
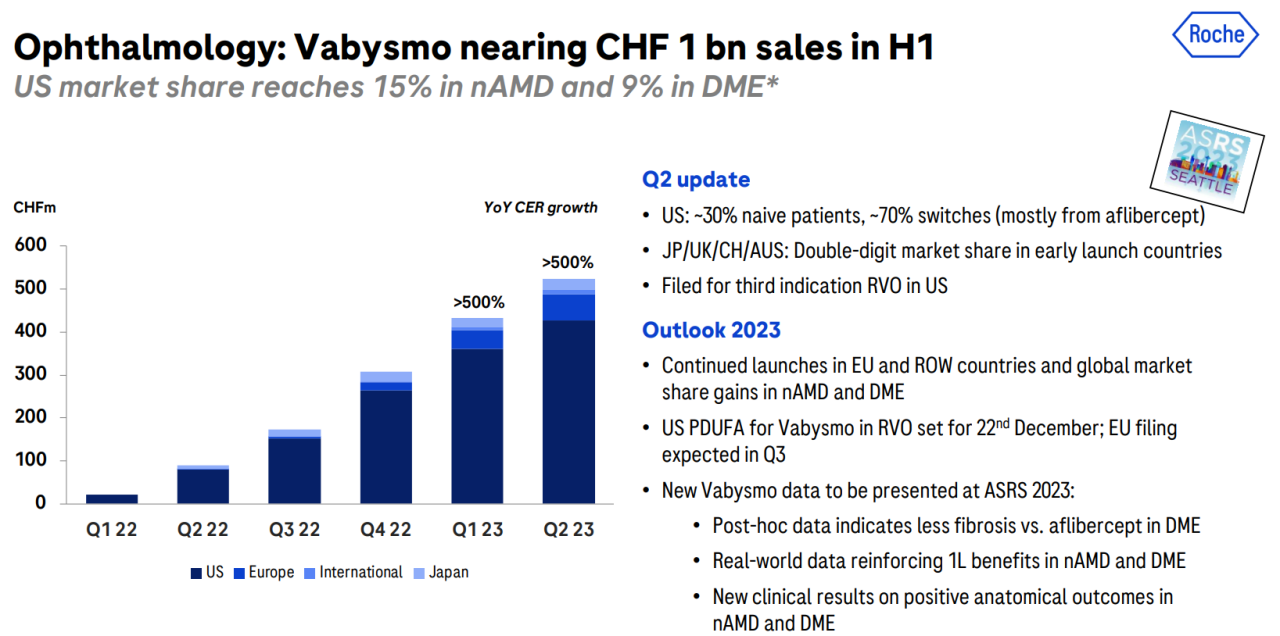
图8. Vabysmo2022年至2023年不同季度销售额
Vabysmo正在进行几项临床3期试验,包括一项评估Vabysmo在新生血管年龄相关性黄斑变性参与者中的长期安全性和耐受性的研究AVONELLE-X(NCT04777201)和一项评估Vabysmo在继发于视网膜中央静脉或半视网膜静脉阻塞的黄斑水肿患者中的有效性和安全性的研究COMINO(NCT04740931)。
7.Mosunetuzumab(Lunsumio)
Mosunetuzumab 是由罗氏研发的靶向CD20和CD3双抗药物,于去年6月份获得了欧盟委员会的有条件上市批准,用于治疗先前至少接受过两次系统治疗的复发性/难治性 (R/R) 滤泡性淋巴瘤 (FL) 成年患者。
Mosunetuzumab在临床上开展多项在非霍奇金淋巴瘤中试验,包括单药或者与其它药物联合治疗如来那度胺、利妥昔单抗和吉西他滨等(图9)[8]。

图9. Mosunetuzumab在非霍奇金淋巴瘤中的关键临床试验
8.卡度尼利单抗(Candonilimab)
卡度尼利单抗是由康方生物研发的靶向PD-1和CTLA-4 的一种对称的四价双特异性抗体,具有可结晶片段(Fc)(图10),于去年7月份在国内获批上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者(R/M CC)[9]。
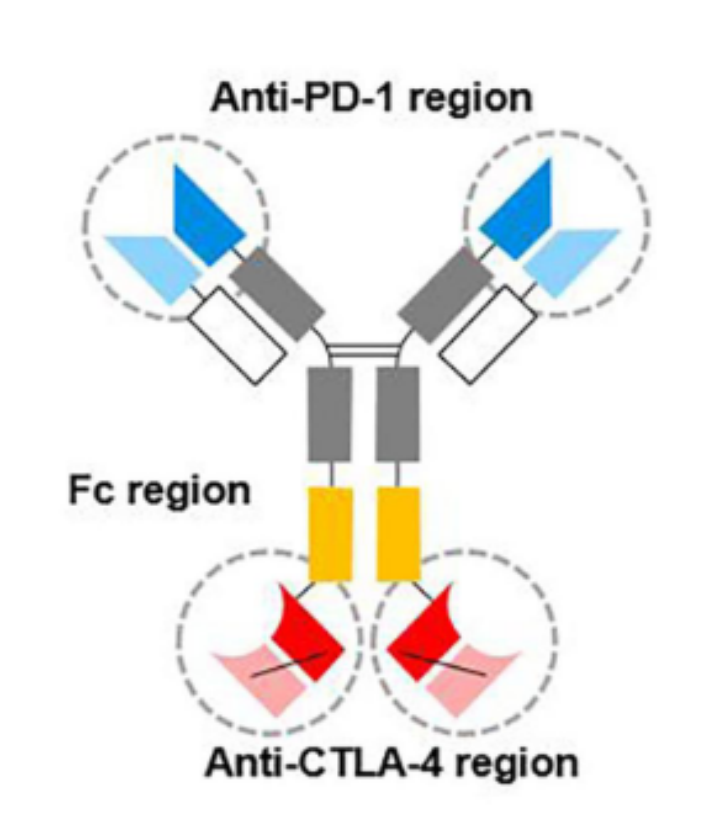
图10. 卡度尼利单抗的结构
卡度尼利单抗是中国自主研发的首款获批双抗药物,也是全球首个获批的PD-1/CTLA-4 免疫双抗,具有里程碑式的意义。
今年ASCO会议上,Shi等人报道了卡度尼利单抗治疗晚期和转移性宫颈癌的安全性和有效性的一项回顾性真实世界研究结果:截至2023年1月20日,对26名中位年龄为54岁(40-73岁)的患者进行了评估。
如图11所示,21名患者仍在接受治疗,5名患者因死亡而停药。在疗效可评估人群(n=24)中,ORR为70.8%(17/24,95%CI:51.2%-90.4%),其中CR为3(12.5%),PR为14,SD为2,DCR为79.2%(19/24,95%CI:61.6%-96.7%)(图11)[10]。
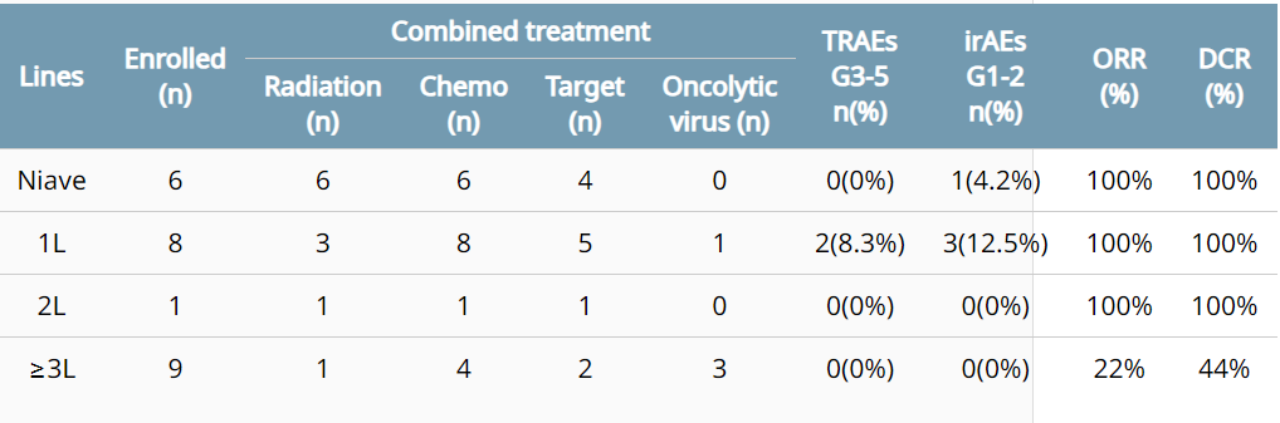
图11. 卡度尼利单抗的临床疗效
卡度尼利单抗在临床上开展多项试验,包括子宫颈癌、胃癌或GEJ癌、结直肠癌、肝癌、非小细胞肺癌和卵巢癌等(图12)[11]。
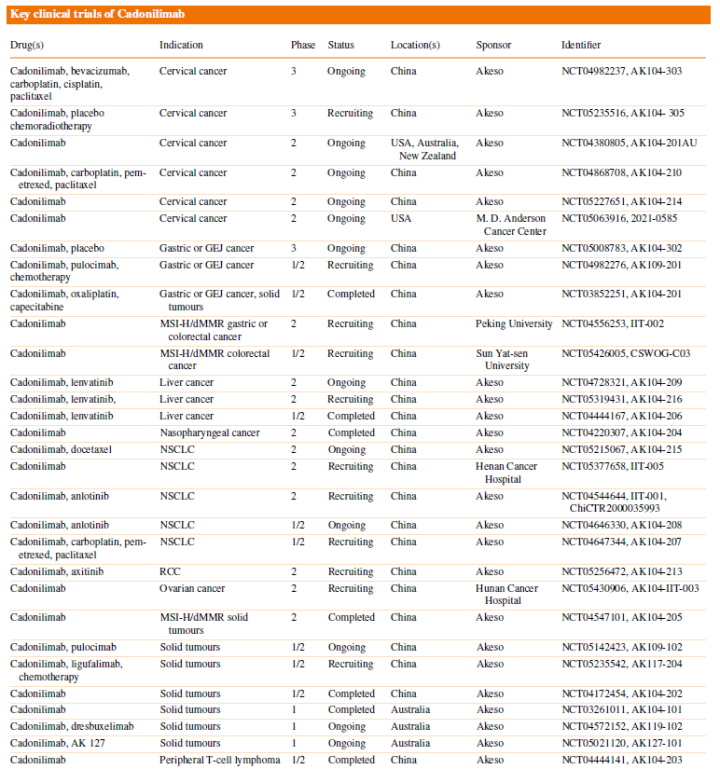
图12. 卡度尼利单抗的临床试验
9.Teclistamab-cqyv(Tecvayli)
Teclistamab-cqyv是由强生(JNJ)旗下杨森制药研发的靶向BCMA和CD3的双抗药物(图13)[12],是通过DuoBody技术构建的1+1非对称IgG4双抗,于2022年10月25日被FDA批准用于治疗既往接受过至少四线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤成人患者。
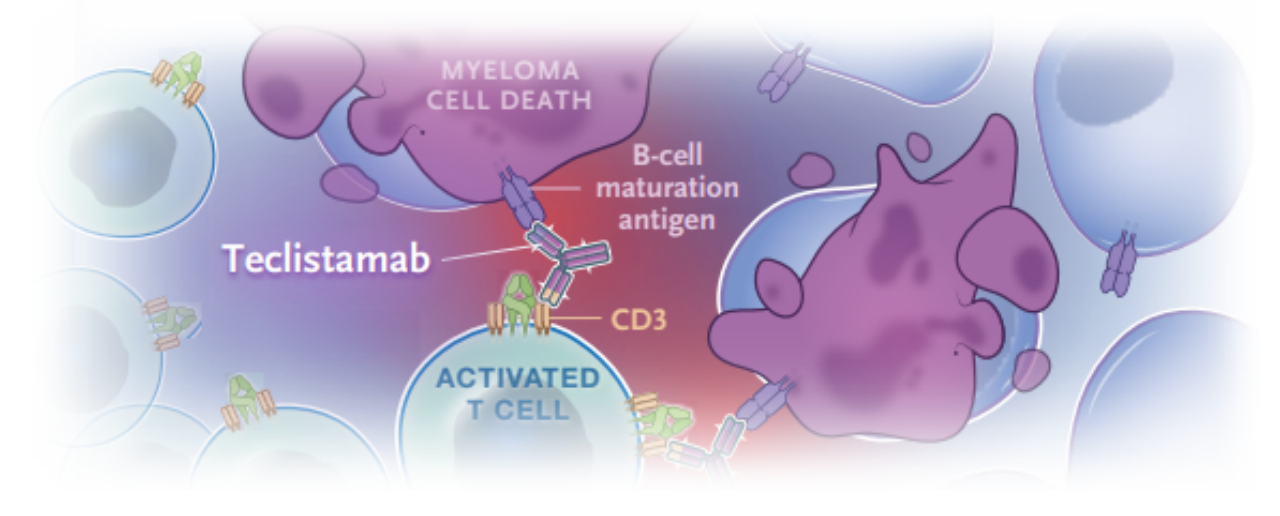
图13. Teclistamab的结构与作用模式
此次获批基于MajesTEC-1(NCT03145181,NCT04557098),一项单臂、多队列、开放标签、多中心的研究。疗效人群包括110名患者的总体缓解率(ORR)为61.8%。应答者的中位随访时间为7.4个月,6个月时的估计缓解持续时间(DOR)率为90.6%,9个月时的估计DOR率为66.5%。
10.Epcoritamab-bysp(Epkinly)
Epcoritamab 是由艾伯维和Genmab共同开发的一种皮下给药的 CD3xCD20 T 细胞参与型双特异性抗体,可激活T细胞,指导它们杀死恶性 CD20+ B 细胞,于2023年5 月 19 日被FDA批准用于治疗复发或难治性弥漫性大 B 细胞淋巴瘤(DLBCL),这是首款获FDA批准治疗DLBCL患者的双抗药物。
此次批准是基于EPCORE NHL-1(NCT03625037)试验结果:疗效人群包括148例复发或难治性DLBCL患者,治疗的ORR为61%(95%CI:53,69),38%的患者达到完全缓解。应答者的中位随访时间为9.8个月,估计的中位缓解持续时间(DOR)为15.6个月(95%CI:9.7,未达到)。
Catherine等人今年在ASCO会议上也报道了这项试验的结果:截至 2022 年 1 月 31 日,已有 157 名患者接受了治疗,中位随访10.7个月时,总缓解率为63.1%,完全缓解率为38.9%。中位持续时间为 12.0 个月(在完全缓解者中:未达到)。总体和完全响应率在关键预先指定的子组中相似。最常见的治疗中出现的不良事件是细胞因子释放综合征(49.7%;1级或2级:47.1%;3级:2.5%),发热(23.6%)和疲劳(22.9%)。免疫效应细胞相关神经毒性综合征发生在 6.4% 的患者中,有 1 例致命事件(图14)[13]。
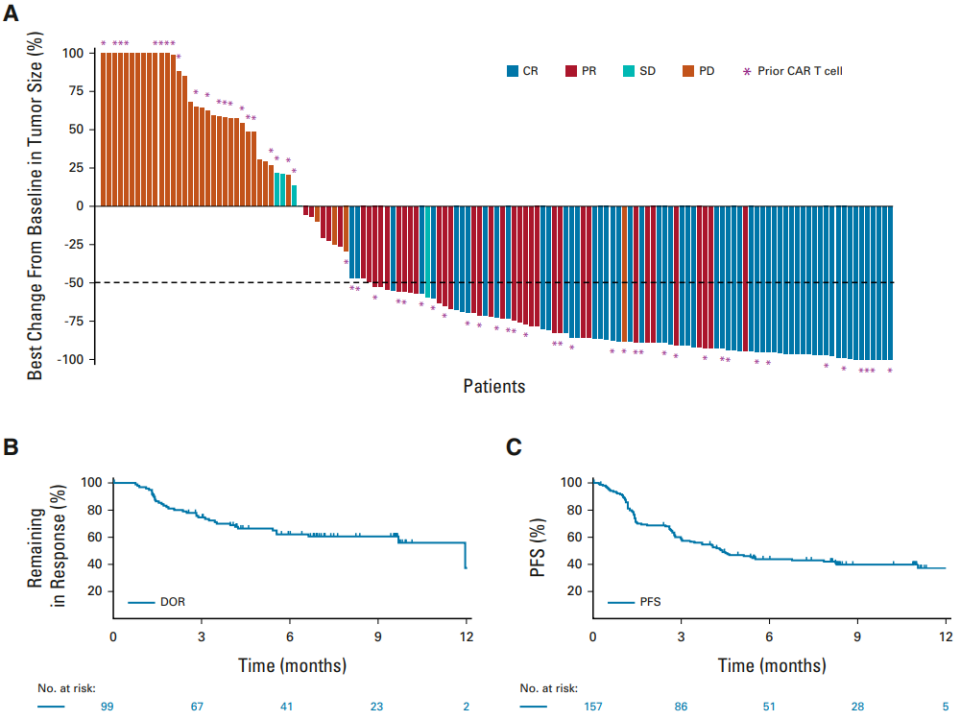
图14. Epcoritamab治疗LBCL患者的疗效结果
11.Glofitamab-gxbm(Columvi)
Glofitamab是由罗氏研发的靶向CD3和CD20的双抗药物(图15),于2023年6月 15 日被FDA批准用于在两线或多线全身治疗后治疗复发或难治性弥漫性大B 细胞淋巴瘤或由滤泡性淋巴瘤引起的大B细胞淋巴瘤(LBCL)[14]。
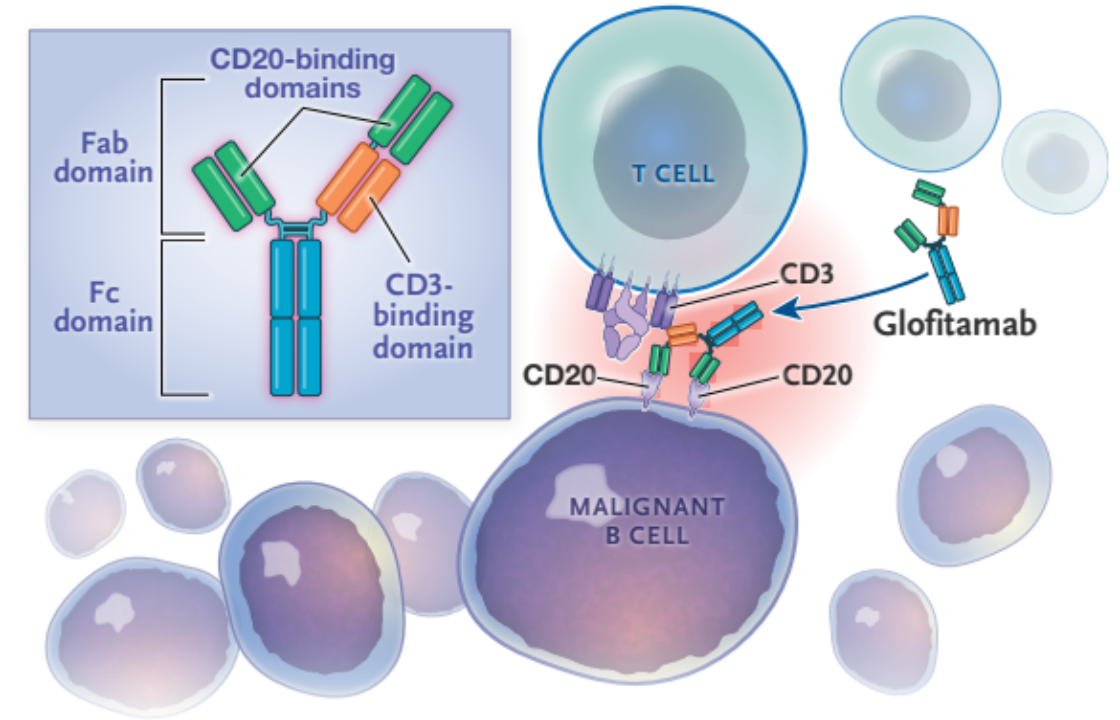
图15. Glofitamab的结构与作用模式
此次获批基于NP30179 (NCT03075696)临床实验结果:132名患者接受治疗,ORR为56%(95%CI:47,65),其中43%达到完全缓解。预估应答者的中位随访时间为11.6个月,中位DOR为18.4个月(95%CI:11.4,不可估计)。9个月的Kaplan-Meier的DOR为68.5%(95%CI:56.7,80.3)。中位缓解时间为42天。
12.Elranatamab-bcmm (Elrexfio)
Elranatamab是由辉瑞研发的靶向BCMA和CD3的双抗药物,于2023年8月14日获批用于既往接受过至少四线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤成人患者。
此次获批基于MagnetisMM-3(NCT04649359)试验结果:接受推荐剂量的97例患者的ORR为57.7%(95%CI:47.3%,67.7%)。在应答者11.1个月中位随访时间时,未达到中位DOR(95%CI:12个月,未达到)。6个月时的DOR率为90.4%,9个月时的DOR率为82.3%。
Elranatamab目前在临床上开展多项MagnetisMM系列试验,用于评估Elranatamab单药或者与其它药物联用或者与其它药物对照的试验疗效(图16)。
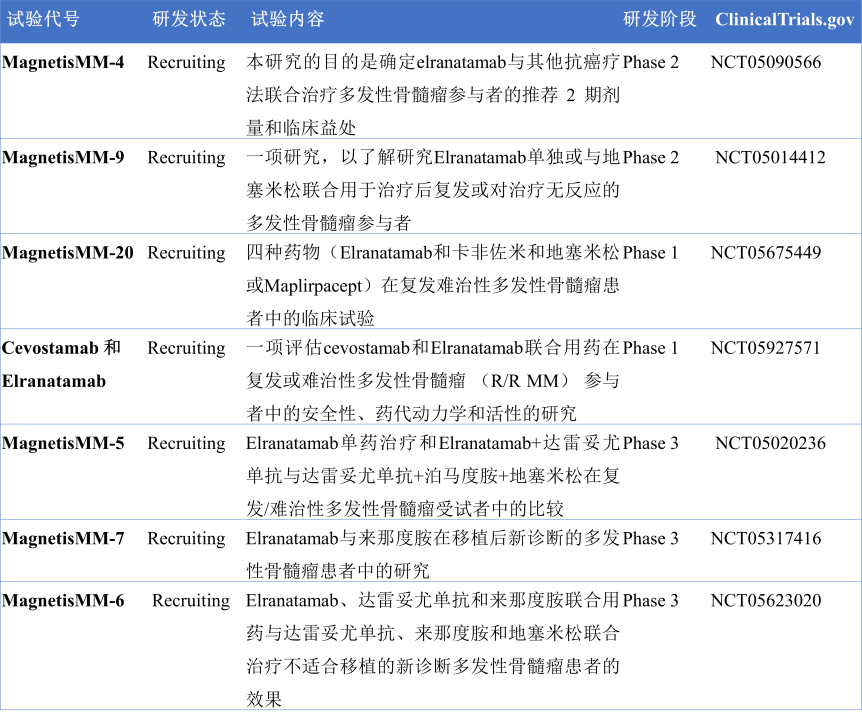
图16. Elranatamab的MagnetisMM系列试验
13. Talquetamab(Talvey)
Talquetamab 是由强生研发的靶向CD3和GPRC5D 的双抗药物,于今年8 月 10 日被FDA 加速批准上市,用于既往至少接受过 ≥4 种前线疗法(包括蛋白酶体抑制剂、免疫调节剂和 CD38 抗体)的复发性或难治性多发性骨髓瘤(MM)成人患者。
此次获批基于一项MMY1001(MonumenTAL-1)的试验结果(NCT03399799,NCT4634552),这项试验包括187名先前至少接受过四种全身治疗的患者。
试验结果显示:每周接受0.4mg/kg治疗的100例患者的ORR为73%,中位DOR为9.5个月。每两周接受0.8mg/kg的87例患者的ORR为73.6%,中位DOR无法估计。据估计,85%的应答者保持反应至少9个月。
在国内,Talquetamab 也已经获得 CDE 的突破性疗法认定,并启动了3期临床研究(登记号:CTR20223266)。
部分临床在研的双抗药物
除了上述获批上市的双抗药物,临床上还有很多在研的双抗药物,其中康方生物的依沃西单抗(Ivonescimab,AK112)和齐鲁制药的Tuvonralimab(QL-1706)都处于申请上市阶段(图17)。
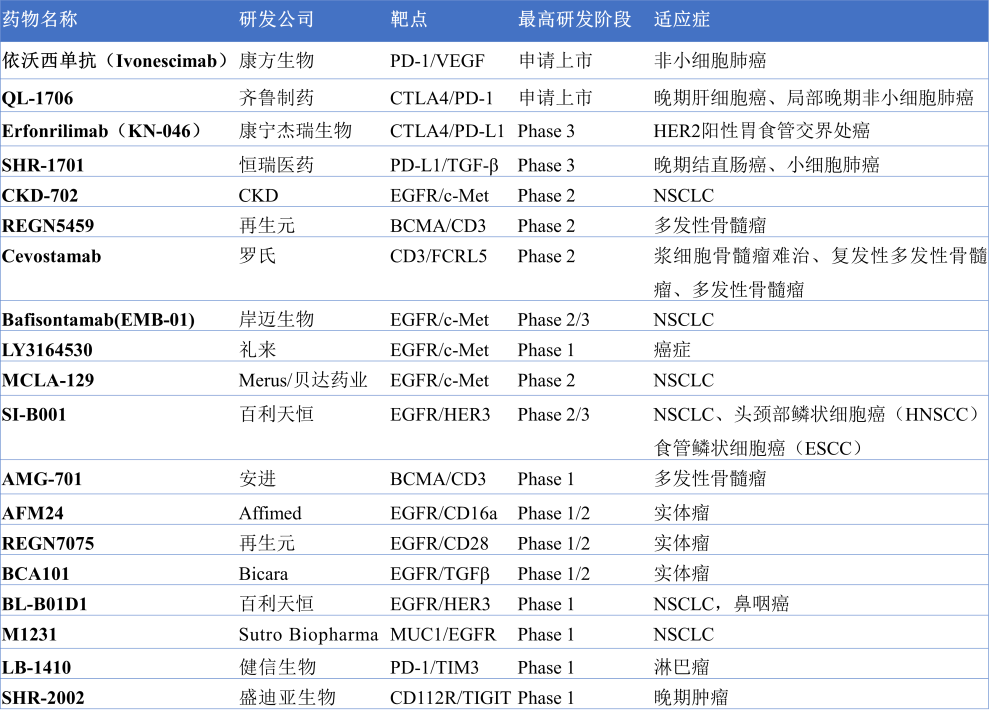
图17. 部分临床在研的双抗药物
依沃西单抗是一种靶向PD-1和VEGF的双抗药物,基于康方生物的Tetrabody技术设计,可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断 VEGF与VEGFR的结合。其抗 PD-1端采用派安普利单抗的结构,抗VEGF 端则采用贝伐珠单抗结构。
今年8月1日,依沃西单抗在国内的申报上市获受理,受理号为 CXSS2300061,用于治疗 EGFR-TKI 耐药的 NSCLC。
此前,张力教授团队报道了依沃西单抗治疗NSCLC的结果:一线治疗EGFR/ALK 突变阴性的NSCLC 患者时腺癌患者 ORR 为 67%,PFS 为 12.3 个月,鳞癌患者 ORR 为 52%,PFS 为 11.0 个月,二线治疗 EGFR-TKI 耐药的晚期 NSCLC 患者时ORR 为 68%,PFS 为 8.5 个月;二线治疗抗 PD-1/PD-L1 抗体联合含铂化疗治疗失败的晚期 NSCLC 患者时 ORR 为 40%,PFS 为 7.1 个月。
QL1706是齐鲁制药开发的同时抑制PD-1和CTLA-4双功能组合抗体,利用MabPair技术平台在单个细胞中以约2:1的比例同时抗 PD-1 IgG4 抗体艾帕洛利单抗(Iparomlimab) 和抗 CTLA-4 IgG1抗体托沃瑞利单抗(Tuvonralimab)。
QL1706在国内的申报上市于8月12日获CDE受理,这是全球首个申报上市的PD-1/CTLA-4组合抗体。
今年ASCO会议上一项旨在探讨 QL1706 联合卡铂/依托泊苷(EC)作为广泛期小细胞肺癌(ES-SCLC)一线治疗的安全性和有效性的 2期试验结果显示:39 例 ES-SCLC 患者中,ORR为89.7%,PFS为5.7个月,中位OS尚未达到。
写在最后
双抗含有两个靶标结合单元,表现出两种不同的Fab(抗原结合片段)状态,它充当具有不同作用模式的两种抗原之间的桥梁。由于双抗是人工构建的功能性抗体,虽然相比单抗有更多优势,但其设计和生产相比天然抗体存在更多难点。
随着双抗技术的进步和成熟,越来越多的双抗药物进入收获期,截止目前,全球已获批12款双抗药物,已获批的双抗药物中艾美赛珠单抗成为重磅炸弹,去年销售额达到38.23亿美元,Vabysmo预计今年销售额有望达到20亿美元,成为罗氏的重磅产品。随着患者人群的扩增,销售额有进一步上升的趋势,证明双抗大有可为。
除了已获批的双抗药物,临床在研的更是数不胜数,国内外纷纷进行布局,包括罗氏、安进和康方生物等。
主要参考文献
1.Yeji Hong, Su‑Min Nam, Aree Moon, Antibody–drug conjugates and bispecific antibodies targeting cancers: applications of click chemistry, Archives of Pharmacal Research 2023
2.Hongsheng Zhou, Qingsong Yin, Jie Jin, Ting Liu, Zhen Cai, Bin Jiang, Dengju
Li, Zimin Sun, Yan Li, Yanjuan He, Liping Ma, Sujun Gao, Jianda Hu, Aili He, Xin Du, Daihong Liu, Xiaohong Zhang, Xiaoyan Ke, Junling Zhuang, Yue Han, Xiaoqin Wang, Yuqi Chen, Paul Gordon, Dong Yu, Gerhard Zugmaier & Jianxiang Wang (2022) Efficacy and safety of blinatumomab in Chinese adults with Ph-negative relapsed/refractory B-cell precursor acute lymphoblastic leukemia: A multicenter open-label single-arm China registrational study, Hematology, 27:1, 917-927.
3.J. Mahlangu, J. Oldenburg, I. Paz‑Priel, C. Negrier, M. Niggli, M.E. Mancuso, C. Schmitt, V. Jimenez‑Yuste, C. Kempton, C. Dhalluin, M.U. Callaghan, W. Bujan, M. Shima, J.I. Adamkewicz, E. Asikanius, G.G. Levy, and R. Kruse‑Jarres, Emicizumab Prophylaxis in Patients Who Have Hemophilia A without Inhibitors, N Engl J Med 2018;379:811-22.
4.Keunchil Park, MD, PhD et.al, Amivantamab in EGFR Exon 20 Insertion– Mutated Non–Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study, J Clin Oncol 39:3391-3402.
5.Byoung Chul Cho et.al, Amivantamab plus lazertinib in osimertinib-relapsed EGFR-mutant advanced non-small cell lung cancer: a phase 1 trial, Nature Medicine (2023)
6.Sohita Dhillon, Tebentafusp: First Approval, Drugs (2022) 82:703–710
7.https://assets.cwp.roche.com/f/176343/x/418a8c95c6/irp230727.pdf
8.Connie Kang, Mosunetuzumab: First Approval, Drugs (2022) 82:1229–1234
9.Xinghua Pang, Zhaoliang Huang, Tingting Zhong, Peng Zhang, Zhongmin Maxwell Wang, Michelle Xia, and Baiyong Li, Cadonilimab, a tetravalent PD-1/CTLA-4 bispecific antibody with trans-binding and enhanced target binding avidity, MABS 2023, VOL. 15, NO. 1, 2180794
10.https://ascopubs.org/doi/abs/10.1200/JCO.2023.41.16_suppl.e17515
11.Susan J. Keam, Cadonilimab: First Approval, Drugs (2022) 82:1333–1339
12.Moreau P et al, Teclistamab in Relapsed or Refractory Multiple Myeloma, N Engl J Med. 2022 Aug 11;387(6):495-505.
13.Catherine Thieblemont, MD, PhD et.al, Epcoritamab, a Novel, Subcutaneous CD3xCD20 Bispecific T-Cell–Engaging Antibody, in Relapsed or Refractory Large B-Cell Lymphoma: Dose Expansion in a Phase I/II Trial, J Clin Oncol 41:2238-2247
14.Dickinson MJ et al, Glofitamab for Relapsed or Refractory Diffuse Large B-Cell Lymphoma, N Engl J Med 2022; 387:2220-2231

