国内首个十亿美元分子诞生!百济神州2023年年报速览
近日,百济神州发布了2023年第四季度和全年财务业绩以及业务亮点。公司2023Q4总收入为6.344亿美元,全年总收入为25亿美元(+73.7%)。其中2023Q4产品收入达6.305亿美元,同比增长86%;全年产品收入达22亿美元,同比增长74.5%。
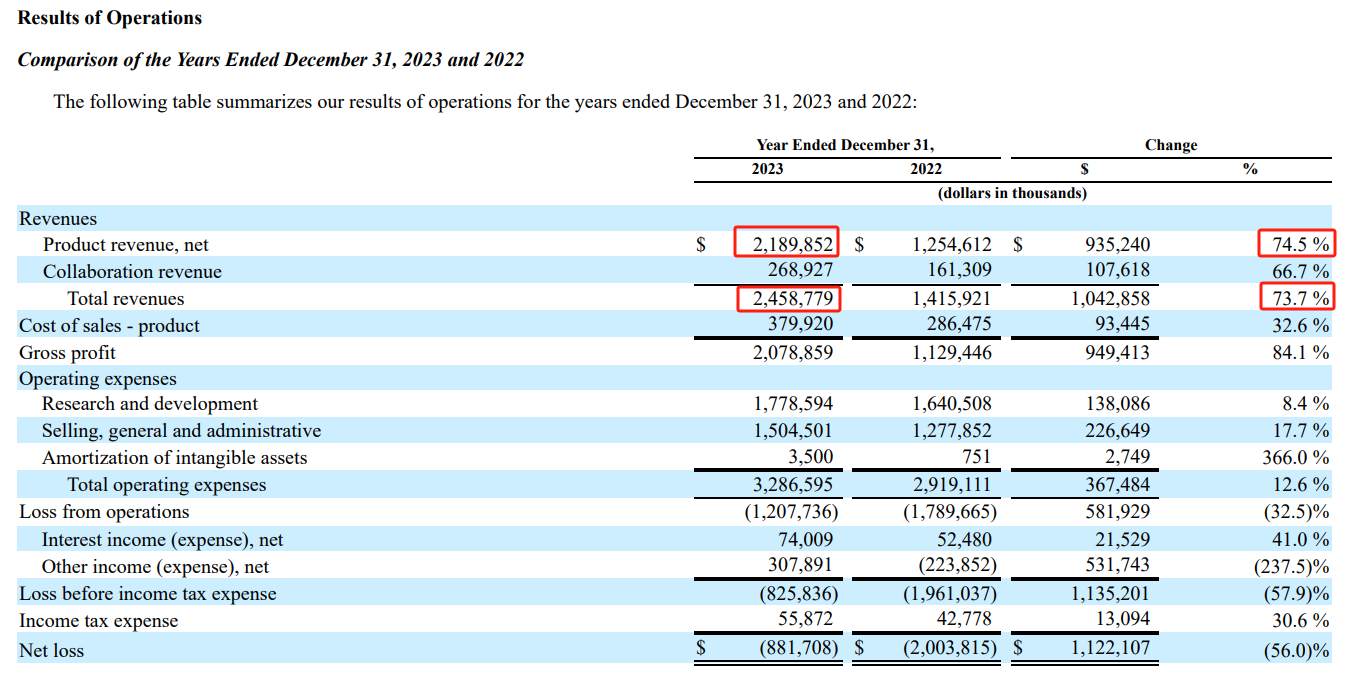
具体产品销售情况
收入主要由核心产品BTK抑制剂百悦泽(泽布替尼)和PD-1抑制剂百泽安(替雷利珠单抗)贡献:
百悦泽
2023Q4及全年的全球销售额分别为4.130亿美元(+134.5%,GBI计算)和12.9亿美元(+128.5%),并在报告期内获得欧盟和加拿大批准,联合奥妥珠单抗用于治疗既往接受过至少两线系统性治疗的复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者,成为首个突破十亿美元的国产创新药。
百泽安
2023Q4及全年的全球销售额分别为1.280亿美元(+25.2%)和5.366亿美元(+26.9%),并在中国获批肝细胞癌(HCC)一线治疗新适应证,以及在英国获批二线治疗晚期食管鳞状细胞癌(ESCC)。
此外,自安进公司授权的产品2023Q4及全年分别贡献了5110万美元(+84.5%)和1.883亿美元(+64.3%)的销售额。
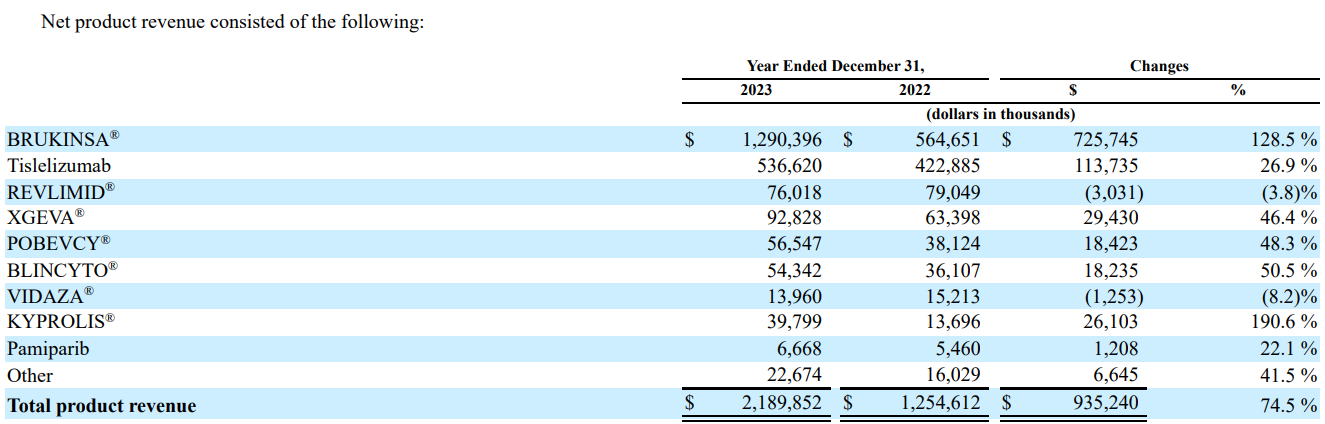
全球市场变化情况
按区域划分,美国是百济神州收入最高的市场,2023Q4及全年的总收入分别为3.132亿美元(+101.5%)和11.28亿美元(+118.9%)。随着百悦泽在美国的销售额持续增长,公司预计将在2024年继续保持这一趋势。其次为中国市场,2023Q4及全年收入分别为2.71亿美元(+32.8%)和11.02亿美元(+31.2%)。这两大市场分别占百济神州全年收入的45.9%和44.8%。
明星产品引领本土创新药国际化
百悦泽(BTK抑制剂泽布替尼)是本土Biotech首个成功出海的创新药,出海时间线如下:
2019年11月15日
获美国FDA加速批准用于二线治疗既往接受过至少一项疗法的成年MCL患者;
2020年5月23日
入选中国CSCO和美国NCCN淋巴瘤诊疗指南;
2020年6月
获中国国家药监局附条件批准上市,用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者,以及既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者;
2023年5月
上述两项适应证转为常规批准,同时另获批两项新适应证:新诊断的成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者,以及新诊断的成人华氏巨球蛋白血症(WM)患者;
现今
已在美国、欧盟、英国、巴西、秘鲁、以色列、加拿大、瑞士、拉美等多个国家和地区获批上市。
在美国市场,泽布替尼的主要竞争产品为艾伯维伊布替尼和阿斯利康阿卡替尼。泽布替尼和阿卡替尼对BTK靶点的抑制更加完全持久,从初代BTK抑制剂伊布替尼手中夺走很大市场份额。2022年,阿斯利康的阿卡替尼销售额超过20亿美元,泽布替尼的销售额为5.647亿美元,而艾伯维的伊布替尼销售额则同比下降逾15%至83亿美元。2023年6月15日,艾伯维通过子公司Pharmacyclics在美国就BTK抑制剂相关专利向百济神州提起诉讼。百济神州回应称,将对专利侵权指控开展坚决辩护。2023年全年,伊布替尼全球销售额进一步下滑17.8%至68.6亿美元,阿卡替尼销售额增长23%达25.14亿美元。
百悦泽的出海成功,引领了一系列本土企业创新药的出海热情。信达生物和礼来合作的PD-1制剂信迪利单抗出海美国失败,被百济神州PD-1单抗替雷利珠单抗打破。2023年9月15日,欧盟委员会(EC)已批准替雷利珠单抗作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者,成为首个成功出海欧美市场的国产PD-1制剂。美国FDA也已经受理替雷利珠单抗的一项上市许可申请,用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者,预计将于2024年7月获得美国FDA批准。
2024年2月26日,欧洲药品管理局(EMA)人用药品委员会(CHMP)发布推荐替雷利珠单抗获得上市许可的积极意见,建议批准其用于治疗三项非小细胞肺癌(NSCLC)适应证,分别为:
联合紫杉醇和卡铂或注射用紫杉醇(白蛋白结合型)和卡铂用于不可手术切除或不适合含铂放化疗的局部晚期或转移性鳞状NSCLC成人患者的一线治疗;
联合培美曲塞和铂类化疗用于PD-L1表达≥50%且无表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)阳性突变、不可手术切除或不适合含铂放化疗的局部晚期或转移性非鳞状NSCLC成人患者的一线治疗;
单药用于治疗既往接受含铂药物治疗后的局部晚期或转移性NSCLC成人患者。
其中,EGFR突变阳性或ALK突变阳性的NSCLC患者在接受替雷利珠单抗治疗前应当已接受过靶向治疗。
未来里程碑
目前,百济神州正在持续推动创新研发战略,在2023年内共推动5个新分子实体(NMEs)进入临床,包括潜在同类最佳的CDK4抑制剂BGB-43395。此外,血液肿瘤新药、BCL-2抑制剂Sonrotoclax(BGB-11417)启动四项注册性试验,包括用于治疗初治慢性淋巴细胞白血病(CLL)的全球III期试验;靶向BTK的蛋白降解剂BGB-16673启动两项用于治疗复发或难治性(R/R)CLL、R/R套细胞淋巴瘤(MCL)的全球扩展队列研究。
百悦泽后续里程碑
预计2024年3月和6月
分别获得美国FDA和NMPA批准,联合奥妥珠单抗用于治疗既往接受过至少两线系统性治疗的R/R FL成人患者;
预计2024年上半年
向EMA和加拿大卫生部递交一项片剂新剂型上市申请;
预计2024年下半年
向美国FDA递交该项新剂型上市申请。
百泽安后续里程碑
预计2024年上半年
向日本药品和医疗器械管理局(PMDA)递交一线和二线治疗ESCC患者的上市申请;
获得EMA批准,联合化疗用于一线和单药用于二线治疗转移性NSCLC;
预计2024年第一季度
向EMA递交一线治疗不可手术、局部晚期或转移性G/GEJ腺癌的上市申请;
预计2024年第二季度
获得NMPA批准,用于一线治疗不可手术、局部晚期或转移性胃或胃食管结合部(G/GEJ)腺癌;
预计2024年第三季度
获得NMPA批准,联合化疗用于治疗既往未经治疗ES-SCLC。

