专题丨内卷不可怕,就怕卷不赢(下篇)
在上一篇报告专题丨肿瘤药头破血流难避免,仿制药+新药一起卷(中篇)里,我们分析了肿瘤仿制药和新药的一系列情况,可以看出,当前我国肿瘤领域仿制药与新药都存在扎堆的现象,热门靶点更是堪称“一窝蜂”似的拥趸。对于这种现象的理解,业内大体上可以分为两派。
一派观点是,同质化研发、靶点扎堆会让竞争环境恶化,而过度竞争的背后往往是价格战。从长远来说,不仅相似品种上市后可能难以实现商业价值,也严重浪费了行业资源,最终结果或许就是“落得一地鸡毛”。
另一派观点是,同质化研发并非坏事。靶向药、免疫疗法、细胞治疗价格高昂,而充分竞争能够避免“一家独大”,充分调动企业拓展临床应用的积极性;也利于产品价格维持在合理水平,降低患者治疗花费。我国生物医药产业从“仿制”到“快速更新”,再到“源头式创新”是需要时间的。
其实,上述两种观点也并不绝对矛盾。“靶向药进集采”、“PD-1进医保”充分说明了品种扎堆必然面临降价的结果。药品降价,减轻了患者的用药负担;而销售额下滑,则让企业叫苦不迭。
现在,肿瘤药同质化竞争的问题无法回避。为适应这种竞争环境,企业采取了哪些措施应对?为我们带来了怎样的启发?
01、在广度上,贴合未被满足的临床需求
当前,我国高发癌种的临床需求仍未被满足。在本专题报告中篇,介绍了近年来我国高发癌种的新药上市情况:我国结肠癌、肝癌、胃癌上市的新药数量很少,食管癌无一款对应新药上市。
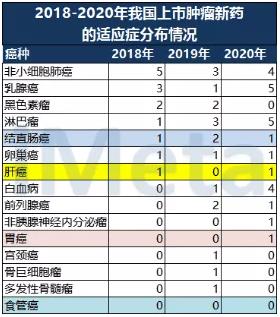
注:上表仅为新上市药物获批适应症,不含已上市药品新增适应症
数据来源:NMPA
以食管癌为例,我国食管癌发病人数较高,约占全球50%以上。基于其病理学特点,我国食管癌多数患者在发现时已是中、晚期,5年生存率不超过20%[1]。尽管手术是治疗食管癌最重要的方法之一,但有研究表明,Ⅰ-Ⅱ期的食管癌患者手术后6年复发率仍高达65%[2]。
由于手术及放、化疗在治疗食管癌时存在局限性,靶向药物在食管癌治疗中越发受到关注。然而,全球食管癌临床试验,多集中在西方患病率较高的食管腺癌上,我国高发的食管鳞癌试验数量很少。
不过,在2020版CSCO《食管癌诊疗指南》中,首次在远处转移性食管鳞癌的二线治疗中增加了PD-1单抗的免疫治疗方案。一系列研究结果,证明了免疫治疗在食管鳞癌中应用的可行性。除二线疗法外,免疫治疗应用于晚期食管癌一线治疗、局部晚期食管癌的临床试验也已陆续开展。
可以预见的是,随着免疫疗法有效性及安全性逐步证实,PD-1单抗拓宽适应症有望使更多患者获益。
结肠癌、肝癌、食管癌等我国高发癌种的流行病学不同于其他国家,现在我国肿瘤患者仍有大量未被满足的临床需求。对于大多数品种而言,在同一治疗领域的疗效往往很难实现突破。相较于同类品种间的降价竞争,更多开发临床急需适应症,对企业而言则意味着更多的患者群体,以及更大的销售空间。
02、在深度上,联合用药为“老药”提供更好的应用策略
无论是“老牌化疗药”,还是“当红靶向药”或“新晋免疫药”,联合用药的重要程度已不言而喻。
现在,在发达国家市场内,化疗药物正被逐渐淘汰,主流治疗方式以靶向药物为主导[3]。然而,现阶段中国肿瘤市场主体以传统化疗药为主,市场份额占比超过70%。尽管化疗在当前肿瘤治疗中有着举足轻重的地位,但临床上单药使用很容易引起人体耐药,导致治疗效果减弱。
为解决耐药难题、减少不良反应发生、提高药品临床效益,已经有越来越多的肿瘤患者在常规治疗时接受联合用药策略[4]。截至2020年11月,clinicaltrials.gov上登记的肿瘤联合试验共计超过5000项。无论是传统化疗药物,还是小分子靶向药物,联合疗法已经成为抗癌中最广泛使用的方法之一,甚至有一些药物从早期临床阶段就开展了两个或多个创新药的联合开发。
单药疗效往往有限,而联合用药可以为患者提供更好的治疗方案。因此,妥善选择联合用药策略,不仅有助于提高患者临床收益、改善患者预后;更有机会扩大“老牌化疗药”的应用场景,拓展企业产品线,延长品种生命周期。
03、研发、生产、销售的取长补短
纵观2020年,在跨境合作上,中国与全球各国的创新药项目许可和合作热情不减。
据美柏医健2020年中国医药境外交易统计数据显示,2020年我国医药license in合作共71项,其中肿瘤领域合作31项,占43.7%;license out合作项目共42个,肿瘤领域合作25项,占59.5%。
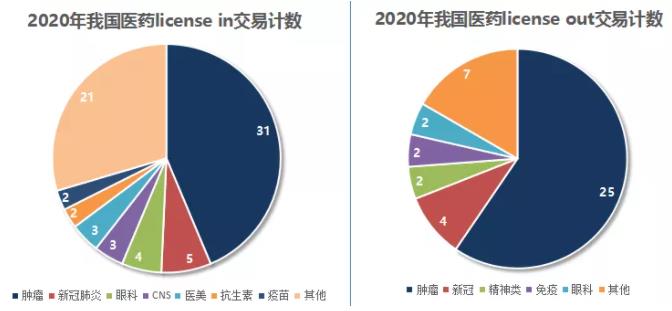
数据来源:美柏医健《2020中国医药跨境交易汇总清单》
在交易额上,肿瘤领域仍是企业引进、授权的焦点。在我国已公布的医药license in项目交易额排名前20位中,肿瘤或肿瘤平台领域占14位;在license out项目交易额排名前20位中,肿瘤领域同样占据14位。
当前,我国企业正进一步开展国际化合作。显然,并非所有企业都“十项全能”,研发、生产、销售环节全都面面俱到。因此,越来越多的企业采用取长补短的合作方式,充分调动手头资源并高效整合资源。
在国内,PD-1已成为研发最火热、竞争最激烈的靶点。据西南证券统计,全球在研PD-1药物数量154个,其中有85个为中国企业独立研发或合作开发。拥挤的PD-1赛道,一定程度上也反应了企业对热门靶点的追捧近乎白热化。
同类产品竞争除了比拼研发速度外,谁能获批更多适应症,谁能最大程度上改进患者生存质量,如何扩大产能并尽快推动商业化落地,也成为企业需要解决的重大问题。
以PD-1为例,特瑞普利单抗是君实生物在国内唯一获批上市的产品,适应症包括黑色素瘤与鼻咽癌。在2020年医保谈判中,互为竞争对手的4家国产PD-1均被纳入医保目录。然而,进入医保目录并不意味着一劳永逸,企业销售、院内推广仍是抢占市场份额的关键。与恒瑞医药1.5万人的销售团队相比,君实生物百余人的销售团队在人数上略显单薄。
今年2月28日,君实生物宣布与跨国企业阿斯利康合作,授予拓益在中国大陆地区后续获批上市的泌尿肿瘤领域适应症的独家推广权,以及所有获批适应症在非核心城市区域的独家推广权,协议期5年,公司继续负责核心城市区域的推广。在中国市场深耕多年的阿斯利康,不仅销售队伍庞大,而且在基层市场中销售能力强劲。
无出其右,在此之前,恒瑞与韩国CrystalGenomics Inc.公司、信达与礼来、百济神州与诺华已分别相继开展了PD-1领域的合作项目。在生物医药领域,企业交流与合作的需要日益迫切,越来越多的企业力争在不同纬度上把有限的蛋糕做大做好。
现在,国内创新企业与跨国企业沟通更加紧密,不同于过去只局限在自己产品的研发上。我们可以看到,商业推广能力相对有限的企业,通过与推广能力强劲、已有销售队伍的企业进行合作,既能节约自建团队投入,也能缩短推广周期,以更快的速度与竞争对手“赛跑”。
药物研发历尽千辛,需要花费大量资源、时间、精力,沉没成本很高;而且,并非所有资本都有足够的信心和耐心来支持企业走“源头创新路线”。各种因素作用,使多数企业更倾向于选择已被证实有效的靶点或化合物。业内有统计指出,我国PD-1临床试验成功率已高于世界水平,但药物研发的成功率高并不意味着能在市场销售中同样取得成功。
先发企业在研发基础、资金支持、市场认可上具有很大优势,对于缺少技术优势或起步较晚的同类产品,随着时间推移,这些后发企业的临床进展、融资以及在市场中放量都可能愈发困难。
通过上述内容我们不难看出,以患者需求为中心、解决患者实际需求,对企业而言意味着巨大的增量市场。为挖掘增量市场,企业已采取了各种积极策略:在广度上拓宽适应症,在深度上开展联合用药试验或加强合作商业推广能力。肿瘤药领域受限于集采和医保降价,也面临相似品种扎堆的现象,竞争压力不容小觑。虽然看似是一片红海,实际上仍有蓝海等待拓展。这片蓝海,就是仍未被满足的临床需求。

