2024年第一季度FDA新药批准
按照最近的标准,2024年第一季度在新药批准方面相对缓慢。今年前三个月只有10种新药获得授权(表1)。相比之下,2023年第一季度为13以上,这一数字与去年随后的每个季度持平或超过。
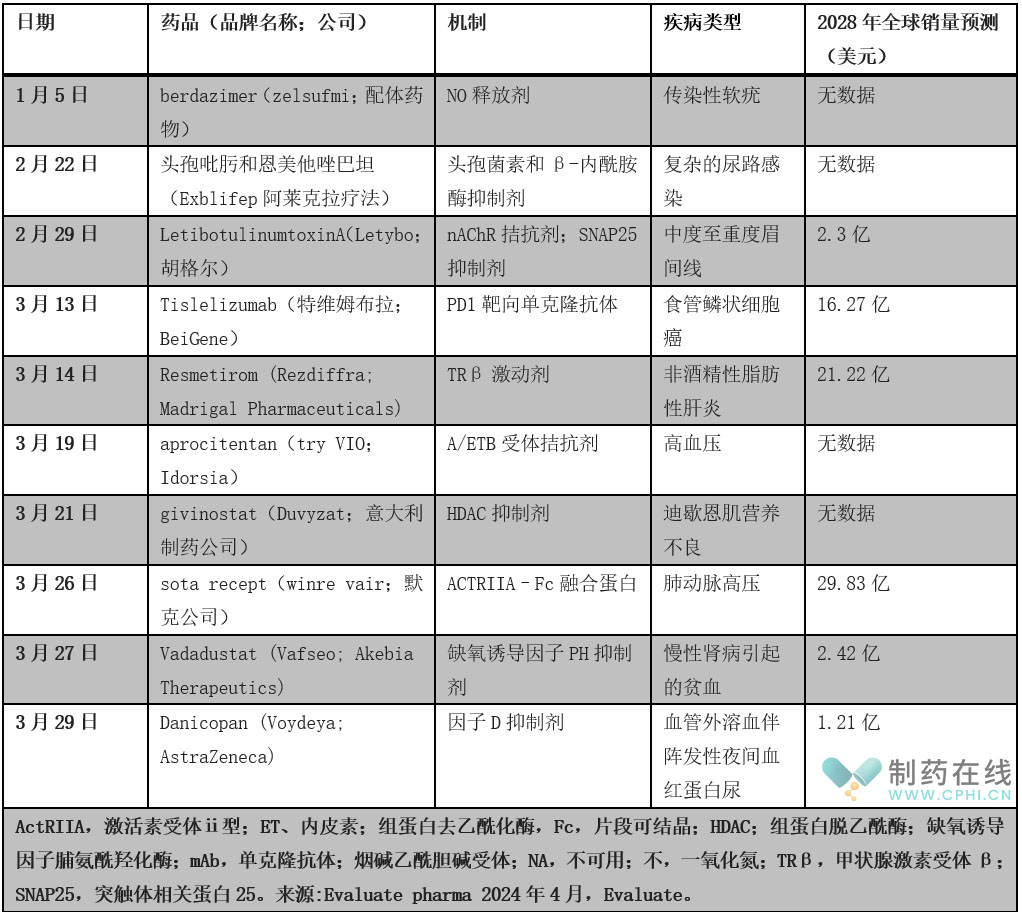
表1 | 2024年第一季度部分FDA新药批准(表格来源于nature)
尽管如此,第一季度的10项审批包括几项预期的重磅项目。Madrigal Pharmaceuticals的Rezdiffra(resmetirom)是甲状腺激素受体β激动剂,是第一个获准用于非酒精性脂肪性肝炎(NASH)患者的治疗方法,非酒精性脂肪性肝炎也称为代谢功能障碍相关脂肪性肝炎(MASH)。鉴于NASH的批准已被证明难以实现,而且该产品现已率先上市,人们对其期望很高,普遍预测2028年的销售额将超过20亿美元。美国食品和药物管理局(FDA)根据一项基于替代终点指标(衡量肝脏炎症和瘢痕形成程度)的加速批准路径,批准Rezdiffra用于患有中度至晚期肝瘢痕的非肝硬化NASH患者。Madrigal需要进行一项批准后研究以验证临床效益,该研究正在进行中。该产品还获得了适应症的突破性疗法、快速通道和优先审查称号。
根据Evaluate consensus的预测,默克公司的Winrevair(sota recept)进入市场后,预计2028年的销售额将接近30亿美元。该产品是一流的激活素信号抑制剂,在STELLAR试验中被批准用于治疗肺动脉高压(PAH),与单独使用背景疗法相比,运动能力显著提高。多环芳烃代表着尚未满足的临床需求,这反映在对该产品的商业期望以及该产品已从美国食品和药物管理局获得的突破性疗法称号中。Idorsia的内皮素A和B受体拮抗剂try VIO(aprocitentan)在本季度获得了进一步的高血压批准,这是第一个针对这一途径的产品被批准用于治疗顽固性高血压。
本季度的第三项批准预计将在2028年前实现重磅销售--Beigene的Tevimbra(tislelizumab),这是一种PD1靶向单克隆抗体,用于治疗既往全身化疗后不含PD-(L)1抑制剂的不可切除或转移性食管鳞状细胞癌(ESCC)成年患者。此前,受冠状病毒肺炎相关旅行限制的影响,Beigene推迟了批准时间。此前,Beigene与诺华的商业合作关系破裂,Beigene重新获得了该产品的全球使用权。该产品也正在接受ESCC食品和药物管理局的审查,将于今年晚些时候做出决定。tislelizumab(替雷丽珠丹康注射液)是一种抗人程序性死亡受体-1(PD-1)单克隆IgG4抗体,由BeiGene开发为免疫治疗抗肿瘤药物。Tislelizumab已在血液系统癌症和晚期实体瘤中进行了研究,导致其于2019年12月在中国获批用于至少二线化疗后复发或难治性经典霍奇金淋巴瘤患者。
在本季度获得批准的其他药物中,意大利制药公司的组蛋白去乙酰化酶抑制剂Duvyzat(givinostat)是第一个在美国获得批准的治疗杜氏肌营养不良症所有遗传变异的非甾体药物,而阿斯利康的voydeya(danicopan)是第一个用于治疗阵发性夜间血红蛋白尿症的D因子抑制剂。杜氏肌肉营养不良症( Duchenne Muscular Dystrophy,DMD),乃遗传性肌肉萎缩病。它的基因( Dystrophin gene)存在于X性染色体中( Xp21 ),因此它是透过性连锁式隐性遗传型态传播的。
其余的批准包括用于传染性软疣的Ligand pharma ceuticals Zelsuvmi(berdazimer)、用于复杂尿路感染的Allecra Therapeutics复方抗生素Exblifep(头孢吡肟和恩美他唑巴坦)、用于慢性肾病所致贫血的Hugel美容药物Letybo(LetibotulinumtoxinA)和Akebia Therapeutics的vaf SEO(vadadustat)。
参考文献:
1.https://www.nature.com/articles/d41573-024-00063-x?utm_source=xmol&utm_medium=affiliate&utm_content=meta&utm_campaign=DDCN_1_GL01_metadata.

