国产首个!恒瑞小分子GLP-1进入III期,挑战达格列净
9月13日,药物临床试验登记与信息公示平台显示,恒瑞子公司山东盛迪医药启动了一项在二甲双胍治疗后血糖控制不佳的成人2型糖尿病受试者中评价HRS-7535与达格列净相比的有效性和安全性的随机、双盲、III期研究。这是首个进入III期临床的国产小分子GLP-1R激动剂,进度仅次于礼来的小分子GLP-1R激动剂orforglipron。
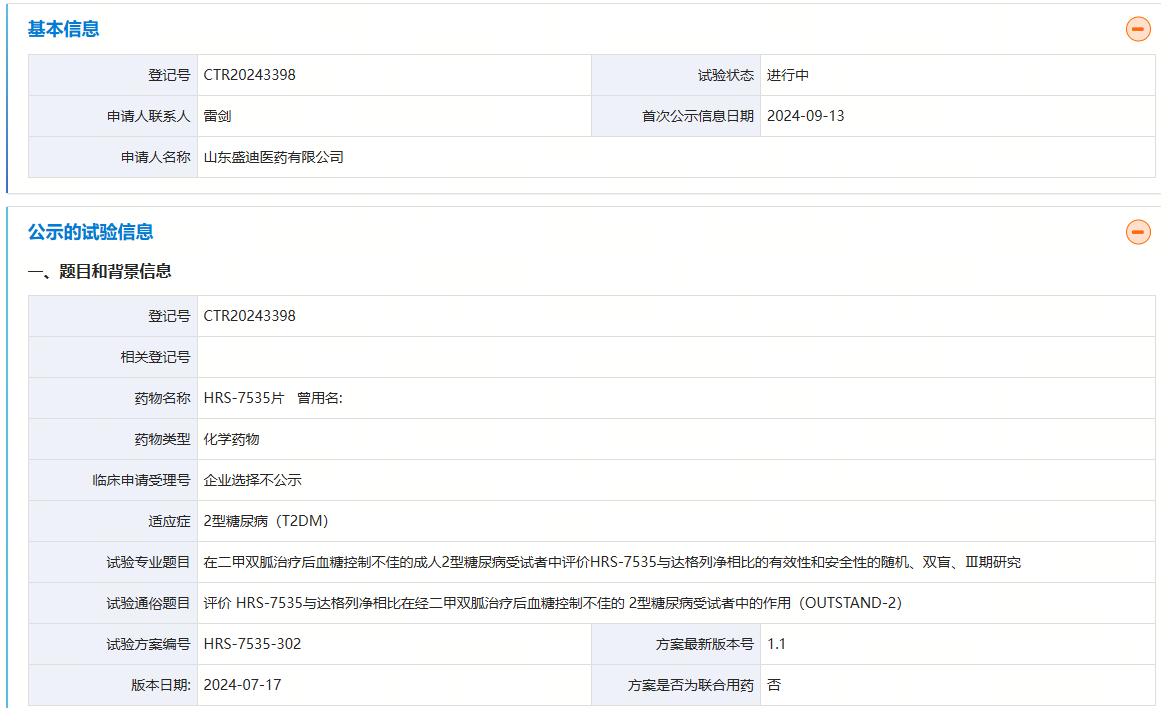
该研究共用药52周,试验组患者每日1次口服不同规格的HRS-7535片剂,对照组患者每日1次口服10mg达格列净片。主要终点指标为治疗第32周时糖化血红蛋白(HbA1c)相对基线的变化。次要终点包括:治疗第32周时达到HbA1c<7.0%的受试者比例、达到HbA1c≤6.5%的受试者比例、空腹血浆葡萄糖相对基线的变化、体重相对基线的变化百分比、体重相对基线的变化和腰围相对基线的变化。
HRS-7535是恒瑞医药自主研发的一种新型口服小分子胰高血糖素样肽-1受体(GLP-1R)激动剂,既可以通过激活人的GLP-1R,促进胰腺的胰岛素分泌和降低胰高血糖素分泌并抑制胃排空,还可以通过影响中枢增强饱腹感和抑制食欲,直接减少能量的摄入等机制用于治疗2型糖尿病和减重。全球范围内尚无口服小分子GLP-1受体激动剂上市。
对照药达格列净是全球首个获批上市的SGLT2抑制剂,可通过抑制肾小管中的SGLT2受体,阻止原尿中葡萄糖经肾脏重吸收后回到血液,促进葡萄糖在尿液中的排泄。目前该药在国内已获批治疗2型糖尿病。
HRS-7535片已完成一项中国单次给药和多次给药的I期健康人试验(HRS-7535-101)。作为国内首个见刊的口服小分子GLP-1受体激动剂I期临床研究,HRS-7535-101数据显示,HRS-7535具有良好的安全性、耐受性及药代动力学特征,支持每日一次的给药方式。值得一提的是,即使基线体重较低(67.6kg),HRS-7535片连续给药4周后依旧可以观察到体重下降4.38kg的明显减重效果。该研究全文已于2023年11月刊登于代谢领域权威杂志《糖尿病肥胖与代谢》(Diabetes Obes Metab,影响因子:5.8)。此外,HRS-7535目前已完成成人2型糖尿病II期临床研究的入组。

