中国生物创新3.0:从跟随到原创,破局点在哪儿?
支持原始创新的生态体系建设与内在能力提升,已经成为当下中国生物医药创新持续释放国际市场影响力的最核心命题。
两组数据充分展露了中国生物医药创新的境况。
一是,中国创新药境外授权出海数量和金额持续提升,且从2023年11月开始,中国创新药海外交易首付款金额,已经超过一级市场募资的金额,这种趋势一直持续至今。正向来看,是中国医药创新能力已经赢得国际市场认可,反过来,这透露出“资本寒冬”下,创新药企用项目换现金,保障持续运营的无奈选择。
二是,近一两年来,中国在研管线数量达到历史高点。医药魔方数据显示,截至今年8月,中国在研新药管线数量高达5380个,其中带有FIC标签的管线数量为1762个,这两项数据都仅次于美国,位居全球第二。
但差异在于,FIC数量占比,美国为81%,中国仅为33%。更进一步,这些具备FIC标签的在研新药中,虽未有较明确的数据展现自来中国的原创靶点有多少,不过,从近5年已获批上市的新药来看,这一数据几乎为“0”。
即使那些已经在欧美主流市场上市销售的国产创新药,亦或是在头对头临床试验中显示出优效结果的国产创新药,更多是在中国“工程师红利”下的赶超,完成了新药从1到N的推进。ADC在中国的爆发,正是基于这一优势。
以近期在美国获批的全球首个CLDN18.2靶点新药为例,全球有70多款处于不同研发周期的同靶点药物,来自中国的在研管线占比接近90%,不止有单抗、双抗,还包括了ADC、融合蛋白等制剂形态。但CLDN18.2靶点早期发现和概念验证都没有发生在中国。
行业已经形成的共识,原始创新能力成为中国医药创新在全球影响力进阶的关键因素。
好消息是,进入“十四五”以来,政策制定者、行业先行者、产业上下游产业链赋能者们,已经充分认识到,突破“内卷”,让中国生物制药创新持续向前的不二路径是提升原始创新能力:在已经构建起从“1到N”的产业创新生态后,再往前一步,实现从“0到1”的创新生态搭建。
仍需努力的是,虽然在2021年发布的《“十四五”生物经济发展规划》中,已经将“提升原始创新能力”作为重要议题,但事实上从这些年的实践来看,包括医疗机构、科研院所、制药企业、生命科学服务提供商等,都在各个链条上朝着这一目标迈进,但集成式创新成果并不显著。
影响因素有很多,既有体制、机制原因,也有技术方面的挑战,同时还包括支撑原始创新整体生态链的完善。
正是基于这一状况,在10月19日召开的“2024上海生命科学创新大会”上,由中国医药工业信息中心主导,思拓凡(Cytiva)支持撰写的《中国生物科技成果转化蓝皮书 2024》(以下简称“《蓝皮书》”)正式发布,从提升科技成果转化效率为出发点,梳理了整个链条中痛点与卡点。
“这份报告是对产业科研转化现状相对比较完整的描述”,思拓凡中国总裁李蕾表示,希望通过这份报告,一方面引起全行业对原始创新、科研转化的重视,同时也希望通过这份报告为提升科研转化能力梳理一套标准路径,“可能会不完美,但有了一个标准后,才能够去改进”。
什么“卡”住了中国原始创新的脖子
事实上,做创新药一直是中国医药产业的夙愿,不管是上世纪60年代执行的“523项目”,还是90年代由科技部主持的“1035工程”,其内核都是为了实现医药创新。不过受限于基础薄弱、人才匮乏、资金不足,这些由政府支持的创新举措,并未有激发起全行业的创新热情。
直到2008年重大新药创制专项的实施,以政府资金支持撬动企业研发投入的方式,使得医药创新开始在全行业形成气候,而2015年药审改革又进一步在药监政策层面,让创新成果更快的落地,随后2018年港股“18A”的推出,接着2019年科创板第五套标准的确立,热钱开始蜂拥至医药产业,让中国医药创新进入到前所未有的巅峰时刻。
其后,因美元进入加息周期,中国医药创新“内卷”挑战不断,加之中国创新药在支付端的破局未达预期,使得中国医药创新由高点迅速回落,但此前积淀对创新的认知,对技术的理解,都为医药产业进入到下一创新周期奠定了基础。
总结来看,中国依靠着巨大的政策优势,使得中国医药产业快速地由以仿制药为主的1.0时代,进入到仿创结合2.0时代。而接下来,当创新与国际化成为大部分中国药企的核心战略指引后,中国医药创新必将迈向以实现原始创新核心目标的3.0时代。
这与李蕾对生物医药创新趋势的观察一致,“我们其实是用十年的时间,走过了西方国家用几十年时间走过路”,且“我们仍然处于创新发展的早期阶段”,而提升原始创新能力,增加科研转化成功率,则是中国生物医药创新,从早期走向成熟的关键一环。
那么增加科研转化成功率的路径是什么?
《蓝皮书》以新药研发流程为线索,将生物科技成果转化路径划分为基础研究、技术创新、成果转化、应用示范四个阶段,并将全球新药研发实践与中国生物医药创新现状相结合,梳理出生物科技转化路径中的两大“卡点”:“死亡谷”与“达尔文海”。
“死亡谷”包括概念验证、成药性研究、药物优化三个环节,其中概念验证是关键一环;“达尔文海”包括中试熟化、临床试验I期、临床试验Ⅱ期,其中临床试验结果安全性有效性的验证,以及项目管理、风险管控是其中的关键。
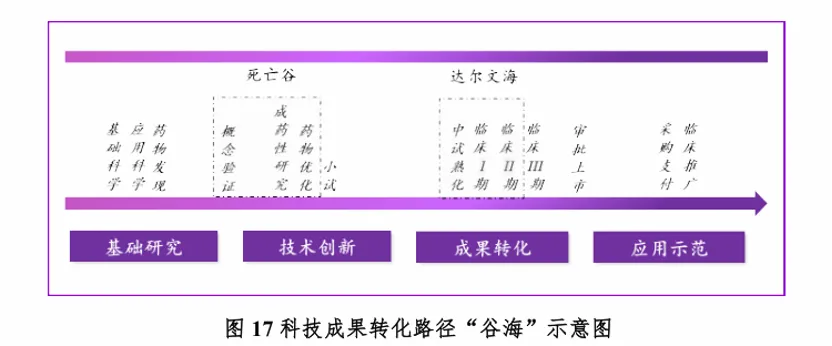
虽然两大“卡点”在科研成果转化中角色不尽相同,但不管穿越“死亡谷”还是横渡“达尔文海”,都需要以先进的科研仪器设备和技术平台为基础,构建起一个学、研、政、企、资等各个链条互融互通,以推动原始创新为目标的生态。
思拓凡正是看到了这样的需求,在母公司丹纳赫“创升中国”战略指引下,以内部业务整合推动外部客户需求满足的逻辑,梳理业务线与能力线。“思拓凡是丹纳赫投资350亿美元打造的一个品类最广、业务链条最深的生物技术创新工具平台”,目前,思拓凡设有四大业务板块,分别聚焦于生物工艺、科研与诊疗、基因药物,以及智能融合方案提供。
“精益赋能是丹纳赫的运营管理优势,也是思拓凡的技术支撑理念”,李蕾认为凭借思拓凡的技术、人才、产业理解、监管洞见等方面的积累,希望未来将自身的业务能力,更好地融入到中国生物医药原始创新的体系中去。
事实上,包括思拓凡在内,以原始创新为目标的产业链各个环节已经开始行动。
先行者的经验是什么?
众所周知,科研院所、医疗机构、制药公司是新药研发的主体。按照产业链分工,前两者主要聚焦在基础研究与技术创新,而制药公司则聚焦在成果转化与应用示范。
李蕾观察到,“整个研发链条中,最难的一段是把科研成果“转化”为产业成果”,也就是《蓝皮书》所提及的“死亡谷”与“达尔文海”。而且,大量成果转化由于缺乏专业化服务、市场化路径选择失误或资金瓶颈等原因而夭折。
针对以上情况,从目前中国不同省市的探索来看,其解决方案大都聚焦在两个关键词上:融合与平台化。
如长三角国家技术创新中心利用“拨投结合”帮助早期原创技术跨越“死亡谷”;合肥在全国率先组建成果转化专班,对接中国科大等本地主要高校院所,促进科技成果就地交易、就地转化。
同时,一些如概念验证中心、中试基地等平台在实现高质量科技成果转化方面发挥着越来越重要的作用。北京、上海、广州、深圳、杭州、合肥、成都、青岛等多个城市纷纷出台政策围绕概念验证平台建设、概念验证项目支持、概念验证基金设立等方面展开布局。其他省市也正在陆续跟进,如陕西首个概念验证基金通过中国证券投资基金协会审核并成功备案,佛山等地依托高校科技成果转化中心成立了医工融合概念验证中心等。此外,四川、安徽、辽宁、北京、深圳、长沙、武汉等地提出要建设中试基地,推动更多科技成果从科学研究走向产业化。
值得一提的是,区别于科研院所和医疗机构,以促进科研转化为目标的新型研发机构开始出现。这类新型研发机构的特点是,可以一方面像企业一样依托于市场,另一方面聚焦于科技成果从源头转化。
以《蓝皮书》中提及的深圳先进技术研究院为例,该研究院首创跨越“死亡谷”的“楼上楼下”创新创业综合体。
“楼上”,科研人员开展原始创新活动;“楼下”,创业人员对原始创新进行工程技术开发和中试转化,推动更多科技成果沿途转化,并开展技术成果商业化应用,从而缩短原始创新到成果转化再到产业化的时间周期,形成“科研—转化—产业”的全链条企业培育模式。除此之外,深圳先进技术研究院还设立产业基金,注资成立两家投资管理有限公司。
李蕾认为,“新型研发机构最大的特点是跨界和融合”,而作为能够覆盖生物科技研发和生产领域85%左右需求,以精益赋能为使命的公司,思拓凡在过往的实践中,已经链接构建起一套快速场景化的服务体系。
他希望,通过硬核的产品和技术实力,以及团队的不懈努力,思拓凡能够以中国生物创新赋能者的角色,为中国生物技术科研转化带来更多不一样的解决方案。“接下来思拓凡还将持续本土化战略,将更多客户需求的产品实现本土化生产,增加供应链韧性。” 李蕾表示。

