创新医疗器械改革系列丨关于完善我国医疗器械特别审评通道的思考
创新医疗器械是现有技术的突破、是临床诊疗空白工具的补充,不仅能够保障患者的权益,还能促进科技的进步与产业的发展。然而,创新包含许多不确定因素,因此更需要审评资源的倾斜。特别审评通道的建立则是基于创新产品的固有风险属性,通过优先分配审评资源的方式来助力研发,提高上市效率,满足临床诊疗需求。如何构建合理的审评路径支持创新,是医疗器械审评制度建设过程中重点思考的问题之一。
本文重点从特别审评通道的制度设计角度出发,与创新能力居首位的美国相对比,以此提出对我国医疗器械特别审评通道制度改革的有关思考,推动医疗器械创新研发效率的提高以及创新价值的提高。
中国医疗器械的创新成效
一直以来,医药创新都是全社会共同关注的话题,而创新医疗器械作为医药产业新质生产力的关键一环,驱动医疗器械的创新发展对患者、社会、国家发展都是重要助力。为了加速研发具有显著临床价值、国内首创或国际领先的医疗器械,保障临床使用需求,中国国家药品监督管理局(NMPA)分别在2014年和2017年设立了“创新医疗器械特别审查”(以下简称“创新程序”)和“医疗器械优先审批”(以下简称“优先程序”)两条绿色通道。
整体来看,在系列产业发展政策的支撑下,我国医疗器械产业展现出了强劲的发展势头。2023年,国家药品监督管理局医疗器械技术审评中心(CMDE)受理注册申请13319项、转出注册申请12541项,分别同比增长23.5%和0.8%。在具体创新产品层面,虽然我国绿色通道设立相对较晚,但创新成果屡创新高,量质双收。截至2024年8月,CMDE共受理创新申请2851项,审查通过540项,批准上市创新产品296个,今年1-8月已批准46个产品上市,同比增长12%。从创新器械大类来看,高值耗材和医疗设备成为创新主阵地,共占90%;从二级类别来看,集中在心血管耗材、影像设备等高值产品领域。
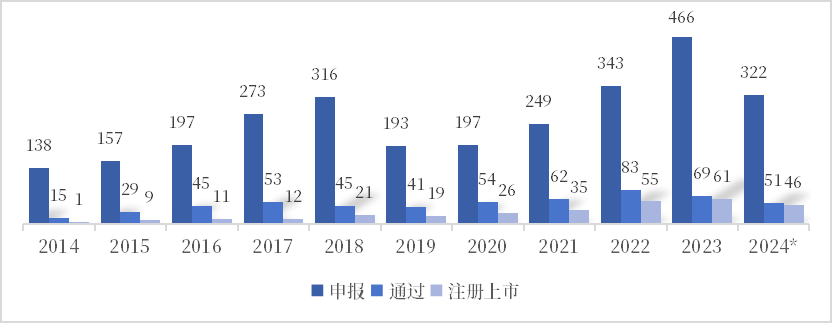
图1 我国创新医疗器械特别审查程序产品申报注册情况
数据来源:CMDE,中国药促会整理
注:2024年统计数据截至8月底。
优先程序在缩短产品注册上市时间方面起到了明显的效果,优先程序中产品经公示到批准的平均用时不到400天,最快的仅100余天。截至2024年8月,CMDE共受理优先申请268项,审查通过84项,批准上市65个。从优先程序产品入选理由来看,列入国家科技重大专项产品占比最多,其次是临床急需产品。由此可见,我国优先程序向上落实国家战略,向下注重患者的临床所需。
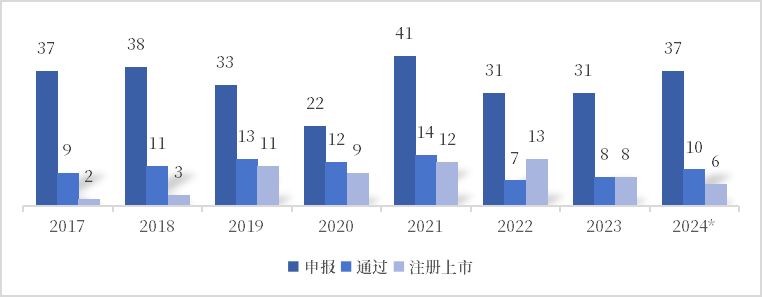
图2 我国医疗器械优先审批程序产品注册情况
数据来源:CMDE,中国药促会整理
注:2024年统计数据截至8月底。
CMDE在标准不降低的前提下,按照“提前介入、一企一策、全程指导、研审联动”的原则,为创新和高端医疗器械的研发上市提供有力的支持。此外,NMPA联合多方力量建立“产学研医”合作平台,成立了人工智能、生物材料及高端医疗设备创新合作平台,促进了相关产品的上市以及技术标准的建立,有力支持相关创新产品的审评与监管。
中美特别审评通道的对比
美国特别审评通道包括以明显临床诊疗优势为主的突破性器械计划、以临床安全性突破为主的STeP计划和面向罕见患者群体的人道主义设备豁免计划(HDE),并未突出创新概念。对比美国与我国特别审评通道设置的具体条件,总结差异,为我国特别审评通道的完善提供思考借鉴,具体见表1。
表1 中美特别审评通道及其条件

资料来源:NMPA、FDA、《突破性设备计划指南》,中国药促会整理
由表可知,中美两国特别审评通道的侧重点不同。美国侧重于从疾病治疗和临床获益角度,聚焦不同维度的临床问题分层建立了特别审评通道,并且发布配套指南详细阐明判断条件(上表1对突破性器械计划的条件解释进行了举例)。中国的优先程序适用逻辑与之类似,主要针对尚无同品种、针对罕见病、恶性肿瘤等未满足临床需求的医疗器械,以及针对老年人、儿童等特殊群体的医疗器械,侧重保障重大罕见疾病与特殊患者群体的临床需求;创新资格的判断条件包括具有核心发明专利、产品基本定型、工作原理或作用机理为国内首创、具有显著临床应用价值四个关键要素,与美国主要差异是在关注临床价值的基础上同时考虑了专利要求。
关于中国医疗器械特别审评通道的思考
创新医疗器械需要审评部门配置更多的资源以加强与企业的交流合作,在审评人力资源相对有限的情况下,不仅创新医疗器械数量逐年增多,CMDE整体审评工作成绩也非常亮眼,2024年上半年首次注册、延续注册、变更注册均在规定时限内完成,审评平均用时分别为95天、70天、25天,第三类产品的首次注册审评用时平均也仅97天。
然而,创新程序的加速度在放缓。创新医疗器械从公示到上市的间隔时长显著延长,由2015年的0.78年增加至2022年的2.7年,见图3。创新产品数量的增多以及技术复杂性的提高都对创新产品的审评带来了挑战。其次,“临床价值”标准不明。我国创新和优先审批资格通过率相对较低,但资格通过后,成功上市率较高,与美国结果截然相反,见表2。笔者推测,导致这一差异的原因一是由于我国特别审评通道中规定的“临床价值”尚未建立详细的规定与判断标准,导致企业申请资料与审评部门的判断不一;二是我国医疗器械“国产替代”为主旋律,全球首创产品相对美国还有些差距,且部分产品的创新要素并不突出。
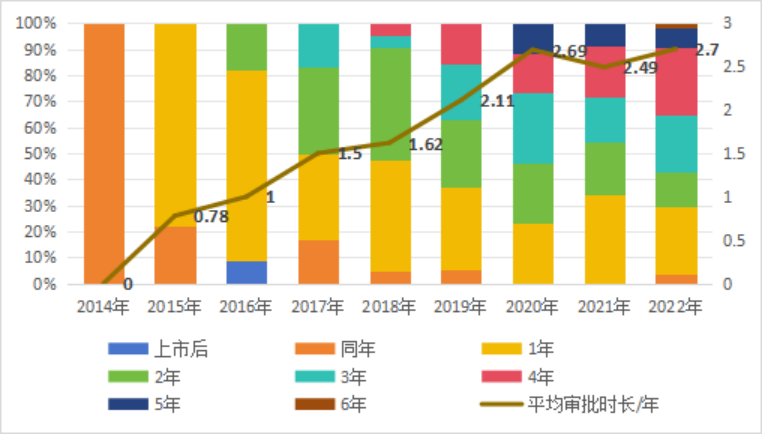
图3 创新医疗器械从公示到上市时间
数据来源:IVF world.
表2 中美特别审评通道资格通过率与成功上市率

数据来源:NMPA、FDA、STAT报告,中国药促会统计
注:统计时间截至2023年,资格通过率=审查通过数量/受理申请数量,成功上市率=批准上市数量/审查通过数量
为构建更好的创新环境,同时也适应我国创新发展现状,首先,建议逐渐打破专利限制,以临床价值为核心建立“创新”分层审评机制。创新程序加速度放缓、创新产品数量明显增多表示着现在有待对创新产品进一步分层,从临床需求角度出发,综合考量多个维度,如临床需求的紧迫性、产品为临床实践带来的价值增量、患者群体特征、患者的使用便捷性,以及技术革新程度、产品安全性能上的突破性进展等来对产品创新等级分层。聚焦不同维度的临床性创新与技术性创新设立审评通道,随之审评人员的配置也会更有针对性。其次,细化“临床价值”的衡量标准,促进各方理解趋同。详细规定临床价值的判定标准,发布相应的指导原则,在有效节省审评资源的同时,更能为企业的价值创新指明方向。最后,打造高水平的审评队伍。鉴于器械复杂性和技术革新的迅猛态势,审评队伍的知识储备需时刻紧跟技术前沿,通过完善资深人才聘用机制、加强审评机构与产业界的互动学习、强化专家智库等方式全方位提升审评队伍专业技术能力。
中国医疗器械产业正加速创新进程,通过细化审评标准并建立分层创新审评机制,能有效提升审评效率,为产业界带来积极的激励效用。同时,创新将成为驱动各方深化合作、构建良性互动的创新互信生态的关键,进一步推动中国医疗器械产业创新能力飞跃提升。
审核:刘子钰、张志娟
参考资料:
1.FDA Webinar: Breakthrough Devices Program Final Guidance.
2.Report to Congress BREAKTHROUGH DEVICES PROGRAM.
3.IVF world. 2022年创新医疗器械报告:总计455款产品进入绿通,41%已上市
4.钱童心.创新医疗器械审批进一步规范化多家本土公司产品进入“待定区”[N].第一财经日报,2024-05-21(A04).DOI:10.28207/n.cnki.ndycj.2024.001855.
5.五年增长30倍!FDA的这种“突破性认定”意味着什么?https://new.qq.com/rain/a/20220827A00Z7K00
6.2022年创新医疗器械报告:总计455款产品进入绿通,41%已上市. https://xueqiu.com/4049282606/241999459
7.最短仅29天!医疗器械创新审批和优先审批大盘点.https://zhuanlan.zhihu.com/p/267364633.
8.突破 | 我国创新医疗器械大盘点.https://xueqiu.com/1419082814/300046788

