GV-971的意义
GV-971(商品名“九期一”)的新闻最近刷遍朋友圈,让大家多少都对其有了一些了解,也再次刷新了大家对AD(阿尔兹海默症)这一尚未有有效治疗手段的疾病认知。谈GV-971的意义,首先要聊一聊治疗阿尔兹海默症已经上市的药物,其基本情况如表-1所示,如大家从各新闻中看到的,距离上一个治疗AD的药品上市已经17年过去。
表-1
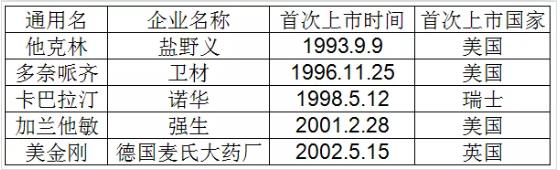
这些被批准上市的药品在我国销售情况如何?表-2、表-3是全部已上市药物在我国的零售及公立样本医院销售情况。没错,是所有上市阿尔兹海默症治疗药物。
表-2
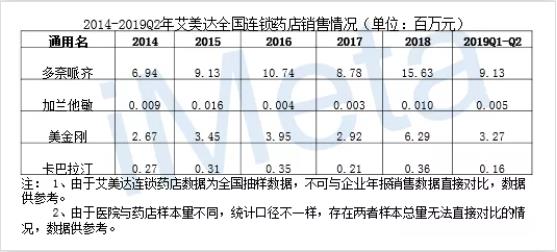
表-3
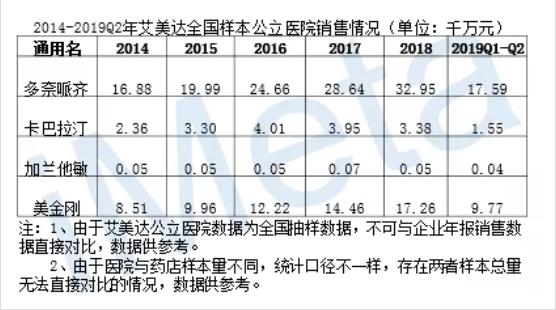
大家可能会好奇,竟然没有他克林,作为首个获FDA(美国食品药品监督管理局)批准上市治疗阿尔兹海默症的药物——他克林,竟然近五年在我国没有销售数据!
不仅仅是没有销售数据,而是根本没有上市,作为第一个上市治疗AD的药物,是技术有难度?专利没到期?还是其他什么原因限制了仿制能力超强的众多国内药企?
都不是,他克林结构很简单,其结构如图-1所示,相比动辄分子量500以上的各种小分子药物,他克林的合成、制剂方面都没有难度,而专利有效期一般是20年,26年前上市的药物,即使抛开当时中国的专利制度尚未成形及临床前研究所耗费的时间不谈,专利也早就不可能是阻碍其在中国上市的理由。
图-1
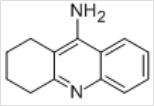
是什么原因使他克林在中国没有上市呢?
原因是他克林会产生明确的急性肝损伤,因不良反应过大,风险大于获益,最终全球退市。如此,治疗AD的药品仅剩4个,加上在2002年后倒在AD新药研发路上各大药企的失败经历,让开发治疗AD安全、有效的新药显得尤为迫切。
据统计,截至2018年1月30日,在美国临床试验网站上登记III期临床的产品有26个及相对应的35个临床试验,处于II期临床的产品有63个及相对应的75个临床试验,处于I期临床的产品有23个产品及相对应的25个临床试验。具体情况如图-2所示。
图-2
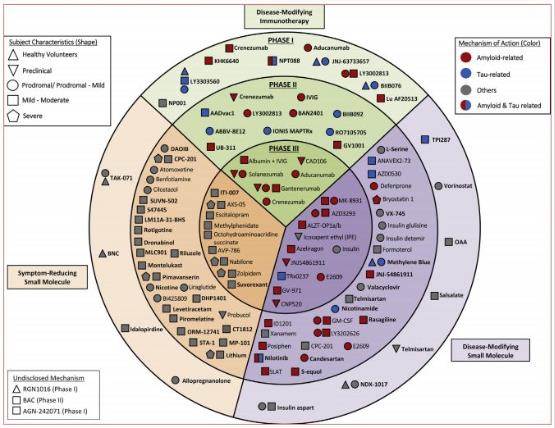
GV-971赫然处于Disease-Modifying 小分子的第一序列。此时,其对外公布的作用机制依旧是Amyloid-related机制即抑制β-淀粉样蛋白,而GV-971最大的争议之一恰恰就是其作用机制的改变,从抑制β-淀粉样蛋白转换成了靶向脑-肠轴机制,这一存在争议的治疗机制,但应注意到其公开发表在《Cell Reseach》上的一段话,其原文如下。

即其开展临床研究是基于抑制β-淀粉样蛋白机制临床前研究的结果。公开发现脑-肠轴机制并非否认其具备透过血脑屏障的特性和对β-淀粉样蛋白的抑制作用,新机制的研究、发表是为了更好的阐释GV-971可能的作用途径,科学上的发现还有待更多研究人员的进一步共同研究确认,但不应是其获批上市的主要依据。
正如在《Cell Reseach》中所提到的,作为治疗中轻度阿尔兹海默症这一无明显身体伤害疾病的药物,GV-971对比安慰剂不良反应很小,即在安全性方面,GV-971几乎无可挑剔。但在有效性方面,GV-971却充满争议,这恰恰是NMPA(国家药品监督管理局)有条件批准甘露特钠胶囊上市的关键条件。
应该注意到NMPA在公告中指出“国家药监局要求申请人上市后继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关试验数据。”这些NMPA所要求的条件,是有时间限制的。换言之,如果GV-971的药品许可持有人不能按时提交,将面临退市的风险!
最近,CDE(药品审评中心)发布了《临床急需药品附条件批准上市技术指导原则》、《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知。文件中对 “附条件批准上市”、“突破性治疗药物”和“优先审批审批”的适用范围、认定条件、CDE的工作程序、公示、提出异议、沟通交流等问题做出了较为详尽陈述。明确了申请人在获得附条件批准上市后,需按照所附的特定条件,开展新的或继续正在进行的临床试验,这些临床试验通常是以确认预期的临床获益为目的的确证性临床试验,为常规上市提供充足证据。
对于临床急需药物,可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上市。申请人应说明所选择的替代终点、中间临床终点或选择早期临床试验数据与预期的临床获益之间的相关性、合理性,并提供相应的证据。这些将是GV-971上市后最重要的工作,而非产品的推广销售。
事实上,因GV-971临床I期最早进行临床是在11年前,监管的严谨程度远不如现阶段。在其结束III期临床后又补做了安全性、耐受性、药代动力学及尿粪排泄的临床试验研究,临床试验编码分别为CTR20181793和CTR20191517,而且相关的毒理研究也在进行中。
作为首个中国批准全球新的治疗阿尔兹海默症药物,GV-971的上市无疑是意义重大的。如最终能够提供足够的有效性和长期安全性证据,将会是我国新药研发史上的里程碑事件;如不能提供足够的有效性证据,即使最终退市,也证明我国新药研发在科研创新、审评审批方面的巨大进步,激发医药行业开发具备临床价值、急需或短缺药品更大的热情,我们中国医药行业基于科学、安全的基础上,创新药敢为天下先。
同时,行业内各种质疑的出现,也暴露出我国药监部门仍需进一步加强与行业交流的问题。在2017年中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》第九条、三十六条中对有条件批准上市及做好宣传解释有明确的表述。“对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面等急需的药品医疗器械,临床试验早期、中期指标显示疗效并可预测其临床价值的,可附带条件批准上市。”“药监部门应做好宣传解释,及时解答社会各界关注的热点问题,主动回应社会关切,合理引导各方预期。”
对于此次GV-971有条件获批引起的社会热议,可以把各界不同意见提交专家咨询委员会公开论证。在重大决策涉及的专业问题上与行业专家进行沟通交流,客观公开的论证才能够消除行业内的疑惑、甚至是质疑。毕竟事实不清,才会给流言四散的机会。
GV-971作为我国医药行业变革的阶段性成果,我们期待后续有良好的临床效果最终让产品能够造福人类,即使最终GV-971临床试验结果未达预期,也将会是我国新药研发的里程碑事件。因为无论最后结果如何,都不会改变我国在政策、市场、投资方面利好创新药研发的大环境。
总之,创新药研发时不我待!

