君实生物特瑞普利单抗即将获批,奠定我国黑色素瘤用药市场先发优势
日前,君实生物的特瑞普利单抗(JS001)上市申请已进入“在审批”阶段,药物申请适应症为黑色素瘤,特瑞普利单抗或即将成为我国首个获批上市的国产PD-1抗体。
君实生物是首家以“新三板+H股”的形式赴港上市的生物科技公司。企业专注于单克隆抗体药物和其他治疗性蛋白药物。目前的核心研究领域包括肿瘤、心血管疾病以及自身免疫疾病。根据企业公开信息显示,其核心管线包括13项在研生物药品,核心产品特瑞普利单抗(JS001)属于肿瘤免疫治疗PD-1单抗药物。
图1 公司在研产品管线
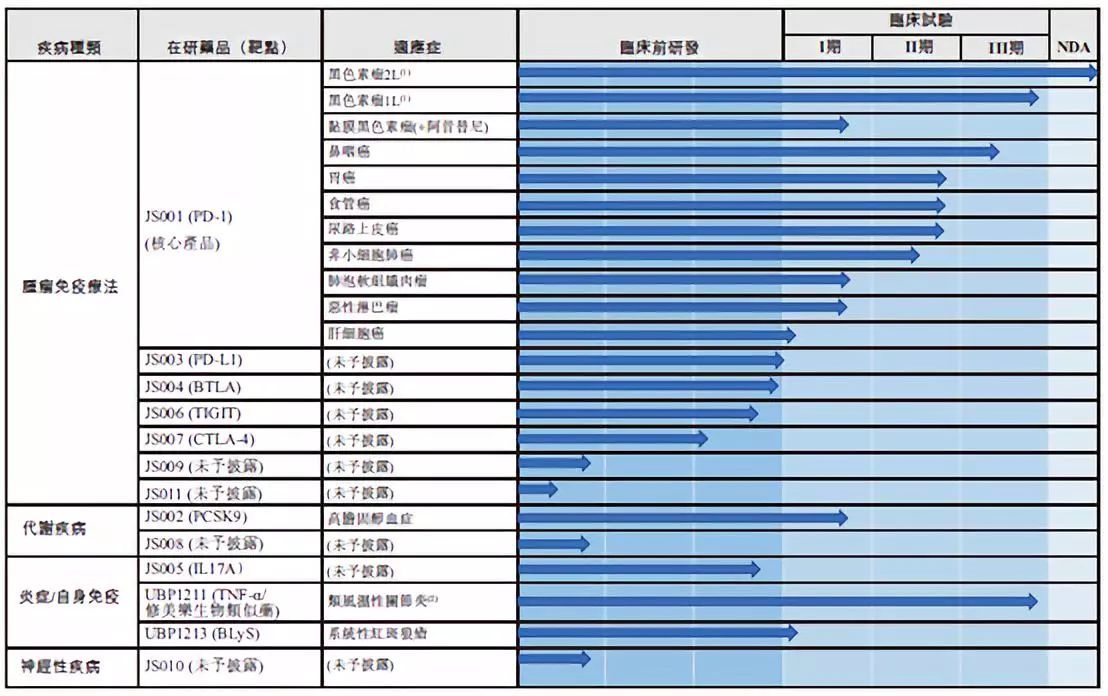
来源:公司官网
企业核心产品
创新药特瑞普利单抗(JS001)
特瑞普利单抗现阶段有多个适应症的临床研究,包括黑色素瘤、肝细胞癌、食管麟癌、三阴性乳腺癌等(见表1)。针对黑色素瘤适应症的上市申请现已进入审批阶段。
表1 特瑞普利单抗临床推进情况
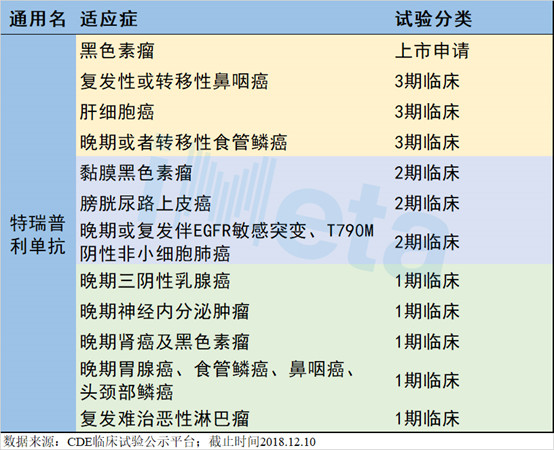
黑色素瘤在我国的发病率较低,属于罕见类的肿瘤,但近年来发病率却呈不断上升趋势,引起人们的关注和重视。
黑色素瘤发病率低,患病人群增长趋势明显
黑色素瘤是一种高度恶性的黑色素细胞肿瘤,多发生于皮肤,亦可见于消化道、生殖系统的黏膜、眼部等处,原发病变约90%位于皮肤。黑色素瘤的常见病理类型有浅表扩散型、结节型、恶性雀斑样和肢端雀斑样等,好发于30~60岁人群,是近年来发病率增长最快的恶性肿瘤之一,年增长率为3%~5%。亚洲国家的黑色素瘤发病率明显低于欧美国家,在中国,黑色素瘤的发病率约为0.6/10万[1]。
全球黑色素瘤临床靶向治疗现状
近年来,黑色素瘤的治疗取得了突破性进展,尤其是个体化靶向治疗和免疫靶向治疗。黑色素瘤细胞主要存在BRAF、NRAS、CKIT等基因变异,针对以上各靶点的药物已经开始应用于临床。
(PS:我国原发黑色素瘤标本BRAF突变率为25.9%,其中V600E是最常见的突变位点(87.3%),这为中国患者使用BRAFV600抑制剂提供了理论基础[2])。
目前国际上已上市的靶向治疗药物有9个,其中小分子化合物有6个(MEK、BRAF抑制剂各3个),生物药物有3个,详见表2.
表2 全球已上市黑色素瘤靶向治疗药物概况
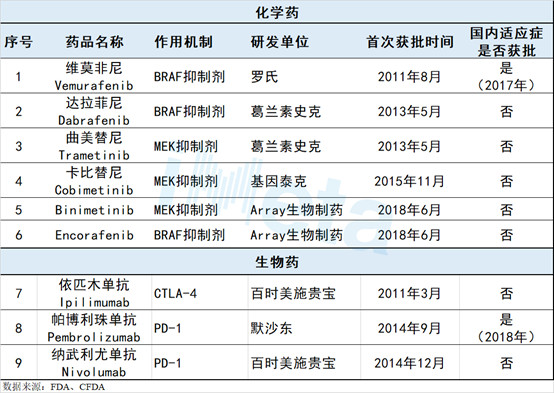
此外,2015年10月,FDA批准了安进公司的首个溶瘤病毒类治疗药物——Talimogene laherparepvec,用于作为首次手术后复发的黑色素瘤患者不可切除病灶的局部治疗方案。
我国黑色素瘤临床靶向治疗现状
化疗药物仍然是我国现阶段治疗黑色素瘤的重要手段。靶向药物近两年才在中国获批上市,进入临床应用。除了进口的两个上市品种外(见表2),Ipilimumab、达拉非尼在我国也已陆续开展临床试验。
除了原研进口品种,国内也不乏企业瞄准该领域,表3为目前国内已开展临床黑色素瘤适应症的企业及创新品种进展情况。由此来看,特瑞普利单抗保持着领先地位,率先获批上市对企业日后的市场占位非常重要。
表3国内临床在研黑色素瘤创新靶向治疗药物
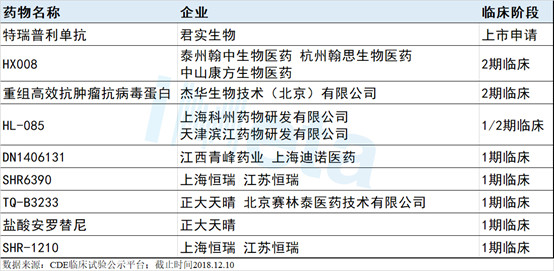
特瑞普利单抗是国内首批申报上市的PD-1品种,在适应症布局上也十分完善。目前来看,我国黑色素瘤治疗刚刚迈入靶向时代,特瑞普利单抗有望率先打开市场空间,奠定先发优势。此外,该品种的鼻咽癌、肝细胞癌、食管鳞癌的适应症也相继进入3期临床,产品后续适应症的开发将利于扩大产品的市场渗透,贡献更大增长空间。
参考文献:
1、中国黑色素瘤诊治指南(2015版).
2、Lu Si,Yan Kong,XiaoweiXu, et al. Prevalence of BRAF V600E mutation in Chinese melanoma patients:Large scale analysis of BRAF and NRAS mutations in a 432-case cohort. Eur JCancer,2012.48(1):94-100.

