2018年11月美国FDA批准新药概况
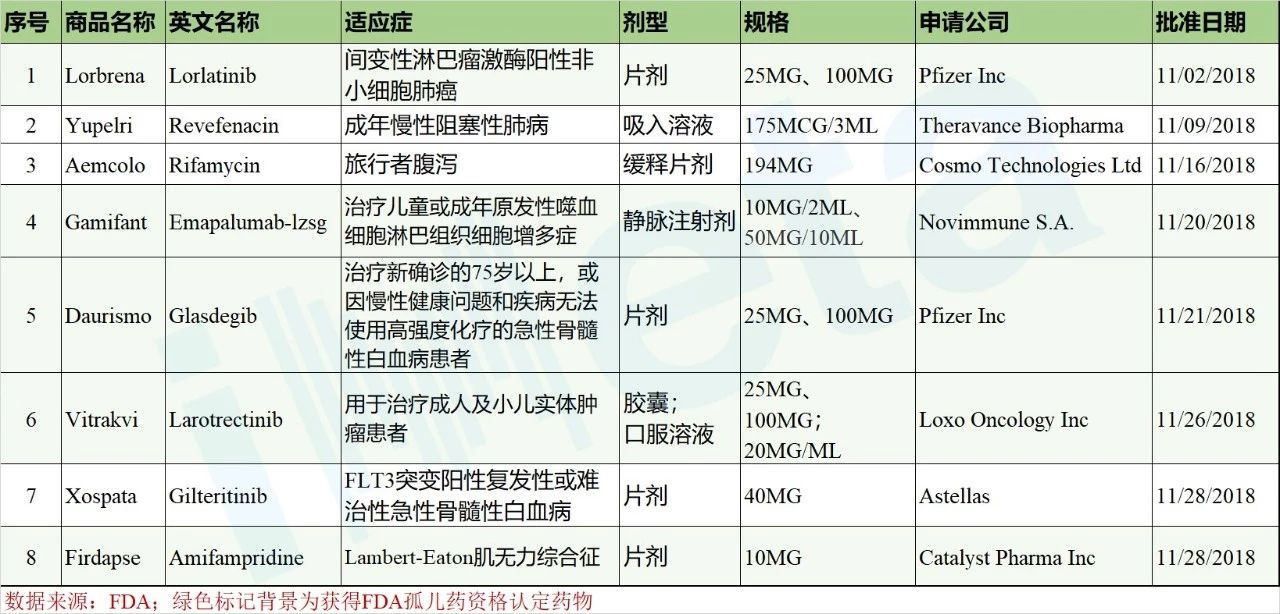
据美国FDA提供的公布结果,FDA在2018年11月份共陆续批准了8款新药,包含7个新分子实体和1个新生物制品;其中就有5个品种为孤儿药,详见表1.
表1 2018年11月FDA批准新药情况
孤儿药获批品种介绍
罕见病是一组发病率和患病率极低的疾病。目前国际确认的罕见病约占人类疾病的10%,其中约80%是由于基因缺陷导致的。药物治疗是应对罕见病的主要手段,用于预防、诊断、治疗罕见疾病的药物称为“孤儿药”。
本月FDA批准的5款孤儿药分别可用于治疗实体瘤、血液性疾病及肌无力综合征,详见下文。
Lorbrena(Lorlatinib)
间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌
11月2日,美国FDA批准辉瑞公司研发的第三代ALK酪氨酸激酶抑制剂Lorbrena(lorlatinib,劳拉替尼)上市,用于治疗ALK阳性转移性非小细胞肺癌患者。
针对大多数ALK阳性NSCLC患者在使用克唑替尼1年后会产生耐药,目前有ALK二代靶向药物Ceritinib、Alectinib、Brigatinib等。Lorlatinib对克唑替尼及第二代ALK抑制剂耐药的肺癌均有效。FDA已经授予其突破性疗法和孤儿药地位。
Gamifant (Emapalumab-lzsg)
儿童或成年原发性噬血细胞淋巴组织细胞增多症(HLH)
11月20日,美国FDA批准干扰素γ(IFNγ)抗体Gamifant(Emapalumab-lzsg)上市,适应症为治疗儿童或成年原发性噬血细胞淋巴组织细胞增多症。HLH是一种非常罕见的高发病率和高死亡率的高度炎症综合征。这是FDA批准的首例针对HLH的疗法。
该药物获批之前,造血干细胞移植是治疗该疾病的唯一方法。而近期治疗目标为迅速控制炎性急症,并为移植做准备。目前,在移植前使用的常规诱导疗法包括甾体类和化学疗法,但这些药物未被特别批准用于治疗HLH。
Daurismo(Glasdegib)
急性骨髓性白血病(AML)
11月21日,美国FDA批准辉瑞公司的另一款肿瘤治疗药物Daurismo(glasdegib),临床与低剂量阿糖胞苷化疗联用,治疗新确诊的75岁以上,或因慢性健康问题和疾病无法使用高强度化疗的AML患者。
Daurismo是一款Hedgehog信号通路抑制剂,也是首款获得FDA批准治疗AML的Hedgehog信号通路抑制剂。
Vitrakvi (Larotrectinib)
成人和儿童实体瘤
11月26日,新型抗癌药物Vitrakvi在美国上市,用于成人和儿童实体瘤的治疗。该药物基于不同肿瘤的共同“生物标记物”,是FDA批准的第一个不区分肿瘤来源用于初始治疗的方法。
具体适应症:该抗癌药可用于治疗携带NTRK基因融合的成人和儿童,并且没有产生已知的抗性突变;局部晚期或转移性实体瘤,而手术切除风险较大,没有有效替代治疗方案。
Firdapse(Amifampridine)
Lambert-Eaton肌无力综合征(LEMS)
11月28日,Catalyst制药公司的Firdapse(amifampridine)获批上市,用于治疗成人Lambert-Eaton肌无力综合征患者。Firdapse是美国市场首个获准治疗LMES的药物。
LEMS是一种罕见的影响神经肌肉接头传导功能的自身免疫性疾病。据估计,在全球范围内,LEMS的发病率为3/100万。
结语
在前10个月中,FDA已经批准的孤儿药有24个,占总获批品种数量的一半(艾美达文章:2018年10月美国FDA批准新药概况),可见美国在孤儿药研发领域的重要性。2018年还剩1个月的时间,还有哪些新药、孤儿药获批?还会有新增药物填补罕见病领域空白?我们拭目以待吧~~

