【艾创投沙龙系列活动】张丹:创新药不放眼全球,将面临越走越窄的风险
2018年2月6日下午,艾美达邀请方恩医药的董事长张丹和中国医药创新促进会秘书长冯岚、信息部主任王敏三位嘉宾,结合多年从业经验,为大家分享了在大变革下的中国医药创新将何去何从。此外,艾美达市场研究部总监张韵与大家分享了艾美达独家数据。

张韵:从精准抽样数据看我国医药市场走向
艾美达市场研究部总监

艾美达市场研究部总监张韵发表了以题为“药品真实世界销售数据研究及历史对比”的演讲。张韵总监通过对比2012年与2017年真实世界药品销售表现,挖掘我国未来医药市场走向。
首先,张韵总监通过对比样本医院与同期医药工业总产值增长情况,发现有7.3%的增长差异,由此推测医药市场中的医院渠道受到政策影响较为显著,尤其是药占比、两票制及药品加成的改革。其表示,医药市场容积及增速符合预期,政策调整带来下滑趋势。
在细分治疗系统中,通过2012年与2017年样本医院数据对比发现,抗感染药物依然坚挺,这其中很大原因是肝炎治疗的高值药品引入,由此带来了抗感染药物排名由2012年第五位,上升至2017年第一位。消化系统增长显著,分析其2017年TOP10通用名排名可以看出,消化系统增长部分与药品副反应控制有关。中药有明显下滑趋势,在中药领域,中药注射剂仍是主导,在2017年百令胶囊成为进入中药领域唯一非中药注射液品种,在市场集中度方面,中药相对较低,市场有待整合。抗肿瘤药掌握着未来医药市场,其新品种迭代最为快速,是创新的体现点。
在具体品种分析方面,张韵总监表示,通过对比2012年和2017年数据发现,神药正在走下神台,高价值、高疗效的药品渐渐体现出来,提示资本关注配合完善销售体系的高质量仿制药,两票制、营改增的代理向服务模式的转变。其次,企业方面显示,国产仿制增长显著,产业集中度逐步提升,强者愈强的整合态势。此外,张韵总监针对肿瘤及免疫调节剂购药数据进行详尽解读。
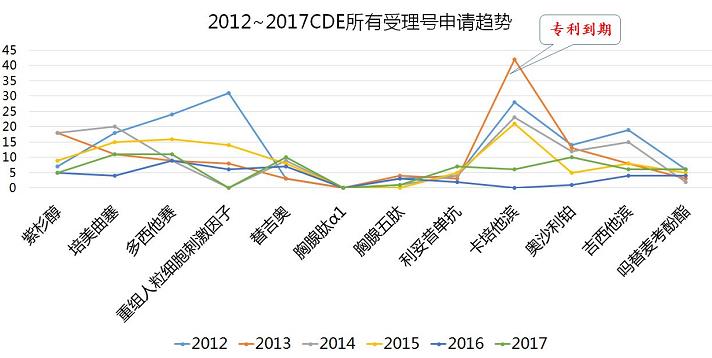
样本医院数据代表着历史数据,那么CDE申报数据则意味着未来市场竞争格局的变化。通过CDE申报趋势数据分析,可以看出新药申报更加理性化,靶向等高价值药品受到的关注度逐渐提升,疗效显著、副反应少的药品更被青睐,专利到期后的申报有“悬崖”趋势,由此提示医药行业大趋势是鼓励创新药。
张韵总监特别指出,2012年~2017年在艾美达全国样本公立医院数据库肿瘤及免疫调节系统购药总金额占比TOP10 通用名CDE申请趋势中,卡培他滨在2013年专利到期时,才在CDE审评受理号数量达到高峰。随着我国知识产权制度的完善,此高峰必将前移,形成真正的专利悬崖。
张丹:ICH环境下的创新药投资
哈佛大学公共卫生硕士
宾夕法尼亚大学沃顿商学院卫生行政管理硕士
北京协和医学院医学博士
20年制药行业经验
Sigma-Tau 全球药物评价和临床开发部门负责人
昆泰跨国公司 VP(大中华区董事长)
CFDA长期顾问
新药审评委员会专家库专家
国家重大新药创制审评委员会成员
成为IFPMA ICH专家工作组成员且成为ICH E19 专家工作组组长

方恩医药董事长张丹博士发表了以题为“ICH环境下的创新药投资”的演讲。张丹博士表示,在医药行业发展历史过程中,因政策导向问题,创新药在国内发展限制较多,机会较少。政府逐渐意识到当前政策对医药创新发展的限制,自从2015年以来,逐步从源头进行深入改革,开始重视临床试验、允许外资创新药首次在中国开展临床、加速外资企业新药进入中国。在2017年,十九大的召开、两办意见的发布和CFDA加入ICH三件大事,揭示了我国未来最大的发展空间是医疗大健康,中国的创新药将会得到更多的重视,投资亦将向创新药倾斜。
张丹博士表示,CFDA正式加入ICH,意味着我国临床试验标准要符合相关标准。2017年年底ICH E17新指南正式实施,将对企业全球现有临床试验设计产生翻天覆地的变化。新指南的发布是为了避免不必要的临床试验,但同时需满足指南技术要求,鼓励I期临床便开展多国多中心试验,并给出统计学办法测算样本量,以及如何有效跟主要ICH国家管制机构进行交流。目前,我国一般企业的药物临床表现尚无法达到以上要求,需要与跨国CRO公司进行深入合作。张丹博士重点强调安全性事件处理相关指南的发布,明确企业需对临床安全性事件进行负责,特别规定药品上市许可人对药品安全性终身负责。
对比ICH临床试验设计考虑,张丹博士表示,安全性最为重要,尤其是创新药对风险管理计划需要非常重视,需要提前在临床试验中设计完善方案。但目前国内企业申办方尚未对以上问题引起重视,这与ICH要求有很大差距。对于估算样本量,张丹博士表示,新指南规定大量安全性考虑和算法,需大量增加样本量;企业若想走向世界,未来遵循ICH标准,在中国,将导致临床试验成本大幅上升。
张丹博士强调:创新药开发应有全球化眼光,仅关注国内市场医保报销,无法获得应有回报,还需关注国际新药注册法规动态,形成全球化产品布局。在中国与ICH成员国实现临床试验数据互认后,利用ICH E17新指南,由国内临床试验转向全球其他国家临床试验,在临床实验设计上与其他主要国家协调一致,避免重复试验、缩减成本和时间,做到全球布局,实现新药最优开发战略。
在大变革的环境下,换道超车或将是企业发展的重要战略。张丹博士针对ICH的挑战与机会提出了以下几点问题:1、如何选择开发产品,2、GCP中心的选择,3、生物医药融资方式,4、现有产品线梳理,5、走向全球市场,6、全球BD,7、更合理的估值。
最后,张丹博士针对生物医药投资提出了以下建议:成本套利-转移临床试验以减少成本;估值套利-利用中美二级市场估值之差进行套利;政策套利-利用各国注册差异,进行多国多中心临床设计套利;地点套利-投资地点不同,直接决定了投资回报的不同,目前长三角最优,其次为环渤海和珠三角。投资团队开始重视临床人员的参与,需多方面配合,形成最佳团队。
王敏:从国际及地方经验探讨我国创新药医保准入路径
中国医药创新促进会信息部主任
中国医学科学院药用植物研究所 生药学硕士

中国药促会王敏主任发表了以题为“从国际及地方经验探讨我国创新药医保准入路径”的演讲。王敏主任介绍了现有医保目录直接调整和医保谈判调整的相关背景,为探索建立创新药品医保准入适宜模式和机制进行初步试水。
我国基本医疗保险从1989年的制度探索期、1998年全面建设期到现在发展完善期,体现出医疗保险体系从“扩面”到“精细化”保障的转变。
随着我国老龄化程度日趋严峻,医保基金开源空间有限,基本医保基金面临保障能力及外部抗风险能力降低的挑战,因此需要优化目录品种结构,建立科学合理的目录调整机制,从源头上控制基金浪费,提高基金使用效率。
为此,人社部对临床价值和价格“双高”药品进行谈判,探索动态准入新机制。2017年在谈判结果公布后,全国31个省市自治区均已发文将36个谈判品种纳入医保乙类目录管理,全部要求直接挂网采购。虽然各省市发文将品种纳入乙类目录管理,但在落地时仍面临部分地市医保部门和部分地方医院的障碍。
为解决以上问题,中国药促会借鉴典型国家和地区药品医保准入的成熟经验,包括美、英、加、澳、德、法、日及中国台湾新药医保准入流程,总结主流成熟经验如下:
典型国家和地区药品医保准入的主流成熟经验总结:
允许企业自主申请的动态医保准入机制
对药品进行分类准入与定价,医保支付价格动态调整
拥有相对独立的药品综合效益评估机构为医保准入提供咨询建议
根据医保制度、产业发展等酌情考虑引入药物经济学评估
医保准入过程公开透明,给予企业表达意见的渠道
我国部分地区创新药准入经验:
建立政府主导、商业保险参与的补充医疗保险制度,保障多层次医疗消费需求
补充保险目录拟入围谈判品种的遴选接受相关组织、团体的推荐,注重药物临床需求重要性、疗效与经济性等综合价值考量
建立评估咨询专家委员会,为医保机构准入谈判提供咨询建议
采用责任医院、定点药房“双通道”保障模式,并引入风险管控机制,确保高值药品获得切实保障
通过国内外成熟经验总结,中国药促会提出建立基本医保目录动态调整核心机制建议:
建立分类调整机制:满足相关条件的创新药动态准入(价格合适的直接准入,价格高的谈判准入),仿制药或过期原研药定期调整机制(定期调整期限另行规定)
自动触发:临床急需、填补临床空白的创新药;改良型新药并已经完成与原创药头对头临床验证;挑战已在医保目录内原研药专利成功的仿制药;罕见病用药
医保药品价格形成机制:以价格高的动态调整品种为试点,国家医保部门谈判形成全国统一支付价,统筹地区制定支付比例(比例核定规则由国家医保部门规定),医保支付价和比例动态调整,搭建信息收集与管理系统,地方探索多元化医保支付方式(个人账户购买商保,针对创新药特殊补偿基金,允许国家医保部门会同商保机构对高值药品开展准入谈判)
退出机制:建议分步走,先将基金费用排名靠前的品种纳入重点监测范围,限制使用,直至剔除;未来向法国学习,有综合价值更好的药品准入则目录内已有比它价值低的品种直接退出(替代性准入)
除此之外,中国药促会还针对建立基本医保目录动态准入的启动程序、动态调整工作实施提出可行性建议。
在沙龙的最后,中国药促会秘书长冯岚女士对本期艾创投主题给予了高度评价,并表示,ICH对中国医药行业的利好将逐渐显现出来;2018年人社部将要对医保目录进行动态调整,创新药进入医保目录的区间将越来越短;此外,港交所将允许零利润、无销售的医药创新企业上市。中国医药创新环境正在逐渐完善,当下是创新的最好时代。

本期艾创投沙龙活动通过分析当下我国医药市场的机遇和挑战,为企业在未来的发展布局拓展思路,获得了在场参会人士的大力赞扬。在未来,艾创投系列沙龙活动将继续举办,欢迎医药与投资人士参加!

