【盘点】24批拟优先的品种能掀起多大的浪?
第24批拟纳入优先审评名单又来了,本次共涉及31个受理号,小编挑选部分品种进行详尽分析,看一看这些药物的市场潜力。31个受理号详细信息请点击:第24批啦!!拟纳入优先审评程序药品注册申请的公示
Palbociclib胶囊
由辉瑞制药有限公司研发生产,分别于2015年11月、2017年8月提交临床申请。
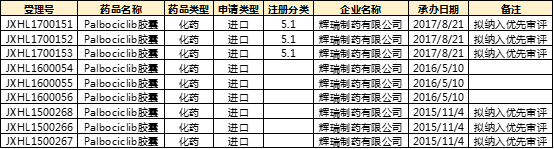
Palbociclib胶囊(帕布昔利布)首次于2015年2月获得FDA批准上市,为CDK4/6抑制剂,适应症为乳腺癌。值得注意的是帕布昔利布是首款获 FDA 批准的周期素依赖性激酶 4/6(CDK 4/6)抑制剂。据了解,自帕布昔利布获批以来,美国医师已将其列为一线治疗的标准疗法。
目前,我国市场中治疗乳腺癌的小分子靶向药物仅有拉帕替尼,为EGFR和HER2双靶点抑制剂,于2013年获得CFDA批准上市,在艾美达全国样本公立医院数据库中显示,拉帕替尼在2017年上半年购药总金额为969万元,2014~2016年复合增长率高达407%。
作为市场中的一批黑马,拉帕替尼正在持续放量,最重要的是在2017年成功进入谈判品种医保目录,药品价格降幅达41%。在这样的情况下,新药想拼价格肯定拼不过的,唯一的出路就是进入医保目录,除非临床疗效超优避免价格厮杀,当然这还需要医生和患者的检验。
此外,依维莫司治疗乳腺癌的适应症正在临床试验中(国内),也即将成为市场中强劲的一个竞争对手。
小编曾经说过,对于研发企业和资本来说,解决无药可用的市场是蓝海,解决无廉价药可用的市场是红海,并且在多次盘点中也提到乳腺癌小分子靶向治疗药物极有可能成为下一个红海。
在前有猛虎后有追兵的情况下,小分子靶向治疗乳腺癌的药品竞争将更加激烈:帕布昔利布优先审评审批公示,依维莫司乳腺癌适应症临床试验进行中,仍有一大波临床申请正在袭来,以2016年为例,便有其他9个品种,41个企业有临床申请状态变更。
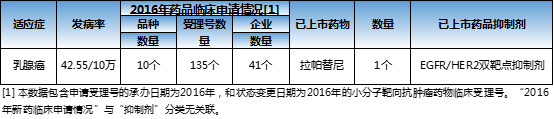
治疗乳腺癌的小分子靶向肿瘤药物或许即将成为下一个红海,想要抢占先机的企业要抓紧了,机会稍纵即逝。
注射用头孢他啶阿维巴坦钠
由辉瑞投资有限公司申报研发,在2015年2月获得FDA批准上市,于2017年9月11日获得CFDA承办临床申请,用于治疗成人复杂性腹腔内感染(c IAI)及复杂性尿路感染(c UTI),适用于治疗方案有限或无可选治疗方案的肾脏感染(肾盂肾炎)患者。
拟纳入优先审评审批理由为“与现有治疗手段相比具有明显治疗优势”,申请事项为“以含中国数据的国际多中心试验结果申请免临床”,也就是说一旦优先审评审批通过后,便可以提交上市申请,这速度是大大加快了。
小编把这个药单拎出来,是因为进口药的国际多中心中国试验免临床真的来了!CFDA于今年10月10日正式发布《国家食品药品监督管理总局关于调整进口药品注册管理有关事项的决定》(本章节简称《决定》),其中第二条便有“在中国进行的国际多中心药物临床试验完成后,申请人可以直接提出药品上市注册申请。”
不过可惜的是,注射用头孢他啶阿维巴坦钠本来可以直接申请上市的,奈何完美的避开了总局正式发布《决定》的时间,哎,造化弄人,等着呗!幸好是拟纳入优先审评审批名单了,要不然按正常流程走,呵呵呵呵呵……
他达拉非片
由长春海悦药业股份有限公司于2017年7月提交仿制药上市申请,用于治疗男性勃起功能障碍,拟纳入理由为“专利到期前1年的药品生产申请”,不过他达拉非片在2015年化合物专利到期,这个,应该是专利到期后2年的药品生产申请吧…
在艾美达全国样本公立医院数据库显示,他达拉非近年复合增长率为15%,在2017上半年购药总金额为232.6万元,占据泌尿系统用药份额4.96%,目前仅有原研礼来有销售数据体现。
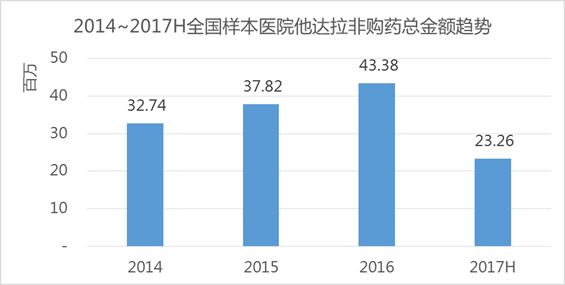
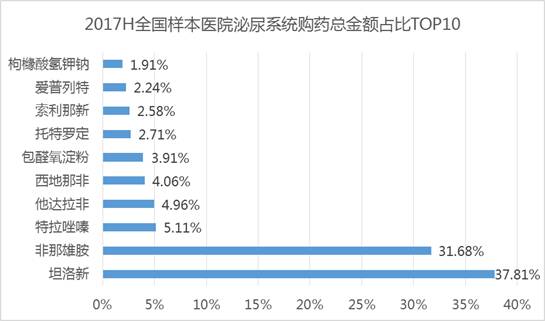
下面我们再看下CDE申请情况,从2013年至今,共有94个他达拉非新药/仿制药申请,共涉及40余企业,当然,这其中有多少个僵尸批文就不得而知了。本次拟纳入优先审评审批名单,具体多快让我们拭目以待吧!
琥珀酸普芦卡必利片
由江苏豪森药业集团有限公司于2017年7月提交仿制药上市申请,用于治疗成年女性患者中通过轻泻剂难以充分缓解的慢性便秘症状。本次拟纳入理由为“专利到期前1年的药品生产申请”,可是同样的,琥珀酸普芦卡必利化合物专利在2015年专利到期。小编想说,这是小学数学还是语文没毕业么?过期时间和前后分不清?
艾美达全国样本公立医院数据库显示,通用名普芦卡必利2017上半年购药总金额为115万元,占据治疗功能性胃肠道疾病的药物份额仅有0.33%,近年复合增长率为31%。
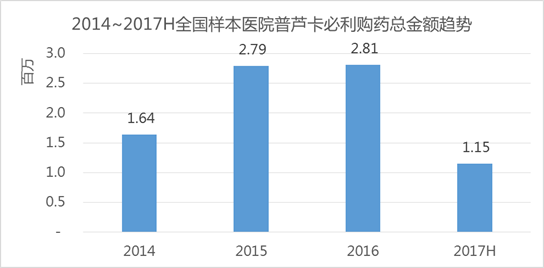
CDE数据显示,琥珀酸普芦卡必利片30个仿制药受理号申请,涉及5家企业,相对较小的市场容量或是造成竞争者少的主要原因。
替格瑞洛
由深圳信立泰药业股份有限公司于2017年3月提交仿制药上市申请,用于急性冠脉综合征(不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死)患者,包括接受药物治疗和经皮冠状动脉介入(PCI)治疗的患者,降低血栓性心血管事件的发生率。与氯吡格雷相比,本品可以降低心血管死亡、心肌梗死或卒中复合终点的发生率。阿斯利康原研替格瑞洛于2013年获得CFDA批准上市,而化合物专利将于2018年专利到期,这才是真正的专利到期前一年提交的仿制药上市申请啊!不过本次拟纳入的理由为“首仿品种”。
在艾美达全国样本公立医院数据库中,替格瑞洛在2017上半年购药总金额为9039.2万元,占据了抗血栓形成药份额的2.34%,近年复合增长率高达113%,市场对于这款药物的认可度还是非常高的,或许有望成为下一个“氯吡格雷”。
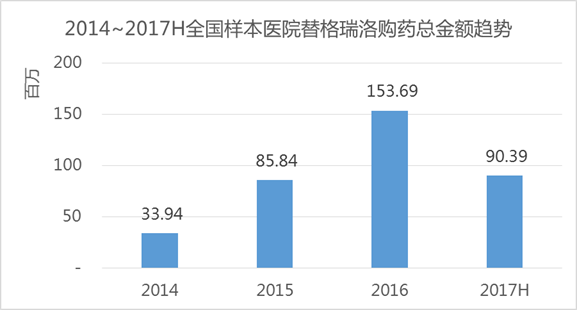
在CDE申请中,共有73个新药/仿制药受理号申请,涉及近五十家企业,从申请情况也可以看出,市场对于替格瑞洛的前景是比较看好的。
本次公示的拟纳入优先审评审批品种尚不要高兴得太早,从以往的审评时间来看,能否达到快速审评仍有待观察,当然这其中或许有临床数据核查的影响。不管怎样,越来越多的优先审评品种正在走向市场,竞争也将更加激烈。

