289一致性评价大摸底,你是哪个阵营?
昨天,沉默好久的总局又开荤了,公布289一致性评价开展与放弃等基本情况。
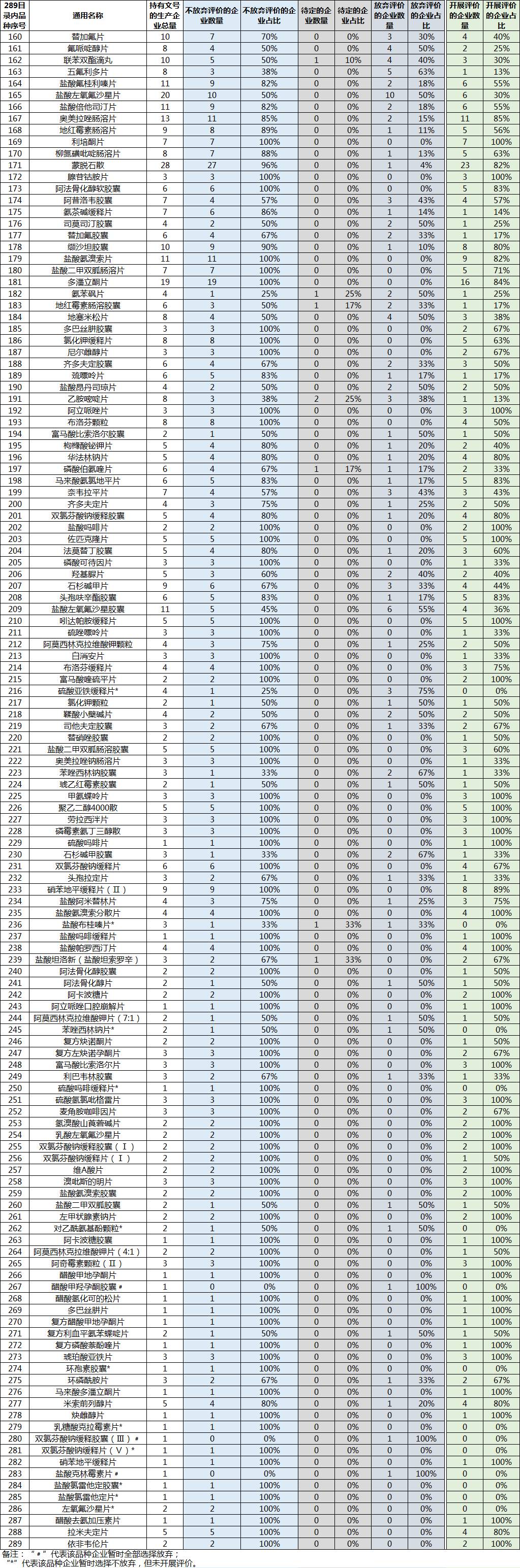
小编进行了统计,明确说不放弃评价的企业占比57%,待定4%,放弃39%,已经开展评价26%。
在2018年底前,289个基本药物药品均需通过一致性评价。不过,理想很丰满,现实很骨感,小编在分析289个品种时,发现了不少问题,由此提出与各位童鞋共同探讨交流。本文分析品种不考虑生物豁免情况。
289个品种的企业能承担得起BE试验费用吗?
289个品种均为基药。何为基药?适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。小编挑选两个重点,一个满足基本医疗卫生需求,一个价格合理。
满足基本医疗需求,翻译成大白话就是:能治好当前的病,但是之后是不是会有并发症和不良反应不好说;价格合理,翻译成大白话就是:非常非常便宜。
由此举个栗子:289个品种中的复方磺胺甲噁唑片,全国中标价中位数在0.1元/片左右,用于治疗各种细菌性感染,但是在临床使用过程中,该药物造成的肝脏损伤较大,在有条件的医疗机构并不作为首选药物。
当下,一毛钱还能干啥?小编想遍所有事情,好像发现一毛钱也就能买基药目录中的药品了…一毛钱一片的药物,小编想利润应该已经可以忽略不计了吧?当然,小编也有可能会想错。
价格低廉直接决定了在当下市场中的份额几乎看不见,在艾美达全国样本公立医院数据库中,复方磺胺甲噁唑片购药总金额仅为一百万元左右,占全身用抗菌药分类的0.06%,共有39家厂家有销售体现,而市场中有该药物批准文号的厂家有近九百家。
相信不少厂家都会放弃该品种的一致性评价,但是,基本药物生产企业入网目录的那些厂家,有责任和义务保证基本药物在市场中的供应。不过,他们也面临着高昂的BE试验费用,基本药物赚不赚钱不好说,但是增加BE试验费用后,绝对是成本的巨额飙升,如果不允许涨价的话,小编想想就心脏病发作了。
有一丢丢欣慰的是,某些省份对一致性评价的企业给予N百万的启动资金支持,但是!!一个品种目前就需要五六百万的一致性评价费用,就算是一个企业做一个品种,那几百万的费用也必然要从厂家其他销售较好的品种口里抢粮食。如果想要做两个以上的品种,除了财大气粗的大企业,小企业已然成为一致性评价的炮灰。
从另一个角度来讲,我国制药行业确实鱼龙混杂,通过一致性评价把末尾的小企业淘汰掉,也是一件对于行业健康发展的好事。但是,对于基药289个品种来说,这里面财大气粗的企业能有多少?
只有一个生产企业的品种,不做一致性评价,药品会“死”吗?
小编在分析过程中,发现有22个品种仅有一家企业有批准文号,比如阿卡波糖胶囊,仅有四川绿叶制药股份有限公司有批准文号。艾美达全国样本公立医院数据库中显示,阿卡波糖胶囊在2016年购药总金额为五千五百万元左右,占通用名阿卡波糖购药总金额的5%左右。相对上文提到的药品来说,阿卡波糖胶囊在市场中表现已然非常好了。
并且,四川绿叶制药股份有限公司是基本药物生产企业入网目录中的企业。也就是说,对于阿卡波糖胶囊来说,四川绿叶有责任和义务保证该药品的市场供应。从公布的摸底清单中,企业已然着手进行一致性评价:在去年提交了参比制剂备案,但目前CFDA临床BE试验公示品种中还未见到阿卡波糖胶囊的身影。
小编对比了仅有一家有批准文号的品种和已处于BE临床公示的品种,发现除左氧氟沙星片外,其他品种均未进入公示目录,也就是说这些“独家”品种均未进入临床启动BE试验。左氧氟沙星片BE临床试验则由长春海悦药业股份有限公司申请,而第一三共制药作为左氧氟沙星片的原研厂家,已在今年年初提交参比制剂申请,目前尚未公布该品种的参比制剂。
小编推测长春海悦以新版注册管理办法申报4类,做完BE后可直接申请上市。(新注册分类实施后申报并批准上市的仿制药将是按与原研药质量和疗效一致的原则进行受理和审评审批。)下面,就是拼两个企业的速度了,谁能控制?老天吧(CFDA)...
如果这些“独家”品种不作一致性评价,CFDA会放水吗?放不放水不知道,但是可以肯定的是,这些品种绝对不会消失,毕竟在基药目录中保障基本用药的。如果这些品种誓死不做一致性评价,除了总局“放水”貌似真的没有别的办法了。但是,总有半路的“程咬金”杀出来,例如长春海悦,当然,前提是小编的推测是正确的。
哪怕“独家”品种厂家不进行一致性评价,总有看准市场机会的企业,不过这个大前提便是产品有足够的市场空间,否则现况将惨不忍睹...例如,三个放弃“独家”品种的药企。
三个放弃“独家”品种的药企,品种分别为:醋酸甲羟孕酮胶囊、双氯芬酸钠缓释胶囊(Ⅲ)和盐酸克林霉素片,在艾美达全国样本公立医院数据库中,三者的购药总金额均不足十万元,由此可见,企业放弃这些品种也算是无奈之举吧。
所以,“独家”品种可不要太大意了,一不留神市场就被别人抢走了。
没有公布参比制剂的企业敢不敢动?目前,临床BE公示品种仍为少数;大限已到之时,都没做咋整?是不是归为存在特殊情形的品种?
43家药企全部选错参比制剂,引发行业热议,本来以为备案没有异议的就可以继续进行下一步计划,哪里知道总局公布的参比制剂没有企业选择的品种,不仅几十万打了水漂,其中花费的精力全部白费,所有工作需要重新来过。
小编粗略统计了下,289个品种中,仍有一百余个品种尚未有参比制剂公布。在289个品种中处于BE临床公示的有31个品种,涉及56家企业,这其中便有4个品种的参比制剂尚未被公布。
那些尚未被公示参比制剂就已经开展BE试验的厂家,胆量真的不小,不过在这个拼时间和速度的年代,风险越大最终赢得市场的机会也越大。
现在离2018年底还有不到一年半的时间,而289个品种仅有31个进行了BE临床公示,一百余个品种参比制剂还未公布,加之能够做BE临床试验的机构都需要提前排队,留给企业的时间真的不多了。到2018年底,那些已经完成的品种自然可以踏实的去拓展市场、抢占先机,但相信还会有很多没有完成的品种,这会不会归为“存在特殊情形的品种,应在2021年底前完成一致性评价”?小编觉得可能性很大。
不过,虽然大限极有可能往后顺延,但这并不意味着留给企业时间会更多,有实力的企业会抓紧时间进行一致性评价,毕竟谁能够抢先通过,就意味着市场的极大倾斜。
临床试验资源短缺问题解决了吗?
对于临床试验机构资源紧张的情况,根据总局的工作计划,已着手开始解决。据了解,全国具有药物临床试验机构资格的医疗机构已达到约600家,但这其中有多少可以开展BE试验的就不好说了。
目前从市场反馈看来,BE试验资源仍然稀缺,费用仍然高昂,企业仍然像热锅上的蚂蚁,只不过有的蚂蚁已经挺尸,有的还在挣扎,有的已经长上翅膀准备起飞。
最后,小编想说的是,从总局发文开始,大部分的企业都是观望态度,望着望着就离2018年年底不远了。这本身就是优胜劣汰的策略,医药行业滥竽充数的日子已经够长了,未来必将淘汰一批小企业。政策愿景是美好的,但是实际执行下来也有很多坑等着企业和政策去填,只能希望走的弯路越少越好。
本文分析有误部分,请各位大侠指正!
289一致性评价开展与放弃等基本情况清单