2017年1类新药优先审评潜力品种盘点
截止2017年上半年,CDE共受理一百余种1类新药申请,这些新药中有多少能够进入优先审评?小编斗胆进行猜测,最终能不能进入事在人为~
阿尔兹海默症
在2017年上半年,共有三个厂家申报阿尔兹海默症1类新药的临床申请,分别为诺华的CNP520、卫材和盈帆达医药咨询(上海)有限公司联合申报的E2609、以及广东东阳申报的HEC30654AcOH。
近期关于阿尔兹海默症最重磅的新闻便是去年11月份,礼来公布一直被看好的阿尔兹海默症(AD)新药Solanezumab三期临床EXPEDITION3中未达到主要临床终点,宣告失败。辉瑞、强生、罗氏、礼来等制药巨头先后在AD领域折戟沉沙,给AD药物的研发泼了一盆又一盆冷水。
据Adis R&D统计,仅在1998到2015年之间,各大药企共推出了123种治疗阿尔兹海默症的药物,仅有三种药物加一种联合治疗方案先后获得FDA的上市批准。然而,无一例外,这123种药物没有一种能够治愈阿尔兹海默症,甚至连延缓疾病进程都做不到。即使是获得FDA批准的治疗方案,也仅起到缓解部分症状的作用。
由此可见,阿尔兹海默症新药研发的失败率高达99%,迄今为止,FDA也仅批准了5个用于改善症状的药物,包括4个乙酰胆碱酯酶(AChE)抑制剂(他克林(副作用过大,如今已不用)、多奈哌齐、卡巴拉汀、加兰他敏)和1 个天门冬氨酸(NMDA)受体拮抗剂(美金刚)。另外,我国自行研制用于治疗AD的天然药物石杉碱甲(huperzine A,商品名:双益平) 已在我国临床上应用。其中多奈哌齐占据了近60%的市场份额,其次为美金刚,近30%的份额。
2016年全国样本公立医院治疗阿尔兹海默症药物购药总金额(单位:十万元)
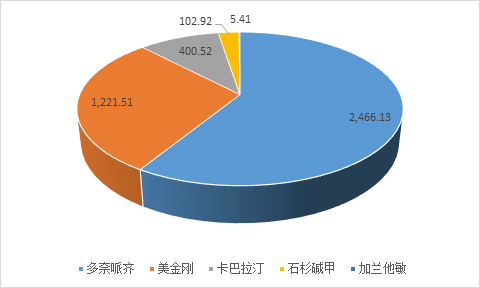
无论是国内外,治疗阿尔兹海默症的临床用药种类屈指可数,大量患者无药可用。截止2015年最新统计数据,我国阿尔兹海默症患者约为1000多万人,是全球患者最多的国家,并且,学界已有预测,如果目前还不采取有效预防措施,到2050年,我国阿尔兹海默症患者的人数可能飙升到3000万人。
此次在2017年上半年申报治疗阿尔兹海默症的1类新药,极有可能纳入优先审评,加速上市。不过,这类药品难度更大的是如何有效治疗,众多制药巨头已在前方探路,后面的小伙伴们希望能够少走弯路,早日成功上市。
特发性肺纤维化(IPF)
本次由广东众生药业股份有限公司申报,与药明康德共同研发的1类新药ZSP1603胶囊提交临床申请,适应症为特发性肺纤维化,若该药物成功上市将打破独家药品的市场现况。目前,我国治疗特发性肺纤维化的治疗药物仅有吡非尼酮,于2014年正式上市销售,由北京康蒂尼药业公司研发生产,商品名:艾思瑞,其上市打破了此种疾病无药可医的现状。
目前,国际上治疗IPF仅有两个药物获批上市,分别是罗氏的吡非尼酮和勃林格殷格翰的尼达尼布,但罗氏和勃林格殷格翰的两个产品均未在国内上市。GlobalData数据显示2015年IPF全球市场为 9.07亿美元,预计2025年将达到32亿美元,但这两个药物价格昂贵,治疗费用较高。
艾美达全国公立医院数据库中显示,吡非尼酮在2015年有销售数据体现,年度增长率82.6%。患者用药负担为月均七到八千,是一笔不小的开支,值得注意的是,吡非尼酮已进入新版国家医保目录,患者的用药负担将大大降低。
2016年全国样本公立医院吡非尼酮购药总金额

此次,广东众生申报的ZSP1603胶囊提交临床申请,未来研发之路还很长,但是吡非尼酮的临床申请厂家已经跃跃欲试,从2009年至今,国内已有多家企业以3.1类向CFDA提出注册申请(2017年尚未有吡非尼酮相关受理号),这其中包括北京凯因科技和正大天晴申报的吡非尼酮上市申请,但是上述两项申请均被列入1622个药物临床试验数据自查核查品种清单中,现已先后公告撤回,其他受理号均为临床申请。也就是说,眼看马上要打破艾思瑞独占市场的局面,结果来了一个急刹车。
另一治疗特发性肺纤维化的药物尼达尼布已进入CDE优先审评名单中。由此可见,鉴于特发性肺纤维化仅一个可选择治疗药物,ZSP1603也有极大可能进入优先审评。
疫苗
据业内统计,2013年国内二类疫苗的市场规模达到近150亿元,随着居民收入的不断提高和预防保健意识的普遍增强,接种率将逐渐提高,我国二类疫苗市场发展潜力巨大,预计未来将保持年均的速度增长。
目前看,国内二类疫苗接种率很低,以流感疫苗为例,国内易感人群的接种率不足2%,而欧美发达国家接种率普遍达到了20%-30%,加拿大更达到45%的接种率,其他疫苗如Hib疫苗、水痘疫苗、轮状病毒疫苗等儿童疫苗接种率也较低,市场潜力巨大。
轮状病毒灭活疫苗(Vero细胞)
轮状病毒是导致婴幼儿发生严重脱水性腹泻的主要病原体,每年在夏秋冬季流行。其主要感染小肠上皮细胞,从而造成细胞损伤,引起腹泻。几乎所有儿童在 2-3 岁之前都被轮状病毒感染过。全球儿童每年因腹泻导致死亡总人数接近 200 万,其中 20-25%是由于轮状病毒感染。 在美国,每年感染轮状病毒的病例数约270万,直接和间接医疗费用接近10亿美元。通过广泛使用安全、经济且有效的疫苗,能够显著降低轮状病毒感染所致的患病率和,死亡率,用药市场潜力巨大。
目前,我国市场中仅有兰州生物制品研究所一家生产,为口服制剂活疫苗。值得注意的是,默沙东研发的口服五价重配轮状病毒减毒活疫苗(Vero细胞)已纳入优先审评名单中,且为上市申请。
本次申报品种由中国医学科学院医学生物学研究所申报的1类轮状病毒灭活疫苗临床申请,而目前现有/即将上市的品种为活疫苗和减毒活疫苗。理论上,灭活疫苗相对减毒疫活疫苗来说,具有更高的安全性。若轮状病毒灭活疫苗(Vero细胞)能够进入优先审评,加速上市,将对现有产品造成巨大冲击。
重组肺炎球菌蛋白疫苗
据了解,在所有疫苗可预防疾病中,肺炎球菌疾病是导致全球5岁以下儿童死亡的重要病因之一。肺炎球菌也被称作婴幼儿“健康杀手”,是引起侵袭性疾病、肺炎和上呼吸道感染的主要原因。严重的肺炎球菌疾病还可能导致耳聋、瘫痪、智力低下等严重后遗症。
早在2015年,辉瑞的7价肺炎疫苗因许可证过期退出中国,直到2017年,辉瑞的13价肺炎疫苗才在国内上市,造成近两年2岁以下婴幼儿面临无肺炎疫苗可预防的“真空期”。目前,针对肺炎疫苗仅有刚刚上市的13价和23价产品,市场空缺巨大。
由于临床用药可选择性较窄,本次由康希诺生物股份公司申报的1类新药-重组肺炎球菌蛋白疫苗,极有可能纳入优先审评中。该公司研发的重组埃博拉病毒疫苗已被纳入到优先审评名单中。
乙肝 丙肝
乙肝
由罗氏提交的1类新药RO7049389临床申请,与传统乙肝药物不同,是一种乙型肝炎病毒(HBV)衣壳蛋白装配抑制剂,以病毒的衣壳蛋白装配(Capsid assembly)为靶点,达到影响病毒复制的作用,被视为抗乙肝药物开发的新靶点。此次申报,极有可能纳入优先审评中。
截止到目前,拟纳入优先审评治疗乙肝药物的有两种,为天士力的治疗用乙型肝炎腺病毒注射液,和吉立亚(杭州)医药有限公司的磷丙替诺福韦片,最终纳入优先审评的为治疗用乙型肝炎腺病毒注射液。
当前被专家公认的乙肝抗病毒药物一共两大类,共五种,分别是干扰素类(普通干扰素、长效干扰素)和核苷类(拉米夫定、阿德福韦酯、恩替卡韦)。在核苷类药物中,恩替卡韦在2016年以23.8亿元购药总金额位居三者榜首,其中价格因素影响较大:原研恩替卡韦片0.5mg全国中标价中位数约(下同)为28元/片,在没有发生耐药突变的情况下,患者月均用药负担为840元左右。对比原研拉米夫定片0.1g价格为10元/片,月均用药负担为300元左右,阿德福韦酯片10mg价格约为6元/片,月均用药负担为180元左右。
2016年全国样本公立医院乙肝治疗药物-核苷类购药总金额
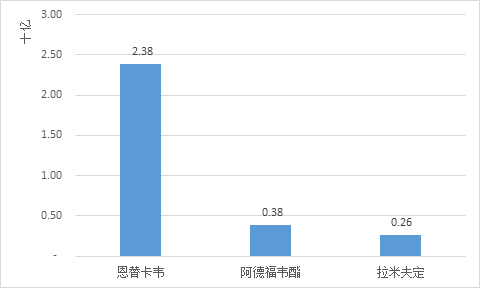
拉米夫定长期服用后,会产生病毒耐药变异等问题,导致病情加重。阿德福韦酯在一定程度上可以解决拉米夫定在服用一定时间后产生耐药问题,但是阿德福韦酯在抗病毒速度方面没有拉米夫定快,起效时间慢,并且同样会产生耐药问题,但出现的机会相对拉米夫定更小、更晚;此外,阿德福韦酯可能会导致肾功能损害。
于2005年底通过CFDA审批的恩替卡韦,与拉米夫定进行临床试验对比,结果无论是肝组织学、e抗原转阴还是病毒DNA数量转阴,恩替卡韦均优于拉米夫定,恩替卡韦抑制病毒速度快,亦不反弹,组织学改善显著。但是,对于患者来说,使用恩替卡韦月均用药负担在800以上,在解决乙肝患者用药选择和负担方面,仍有很长的路要走。
丙肝
北京凯因科技股份有限公司申报的KW-136胶囊制剂已纳入优先审评名单中,此次在2017年申请KW-136片剂,也极有可能纳入优先审评中。
目前治疗丙肝的方法主要有两种,一种是聚乙二醇干扰素合并利巴韦林,疗程持续一至两年。但是近一半的患者不耐受干扰素,会出现骨髓抑制和溶血、肾脏损害、精神异常等副作用,而适用干扰素的患者也仅有60%左右能被治愈。
另一种是口服小分子抗病毒药物,疗程仅12周,治愈率达90%以上,且适用干扰素不耐受人群,在欧美已成为主流治疗方法。但这一领域被国际药业巨头垄断且价格昂贵。以美国吉利德公司的药物为例,其在美国的售价为84000美元一疗程,相当于一天1000美元,总价折合人民币约50万元。2015年吉利德丙肝药物销售额突破192亿美元。
在历次拟纳入优先审评名单中,便有12种丙肝抗病毒药物,虽然市场中治疗丙肝药物屈指可数,但拟纳入优先审评的药物却越来越多;从另一方面来看,那些没有被纳入到优先审评名单中的丙肝申请药物,则在一定程度上意味着未来的市场渐行渐远。
虽然丙肝市场巨大,但是如此多的药物集中在同一时段上市,竞争激烈程度将惨不忍睹,没有足够的临床优势,价格战或成为抢占市场的必经之路。
当然,除以上品种外,抗肿瘤药的部分品种也将获得优先审评资格,筛选条件?肯定是那些临床需求尚未满足的品种。例如?治疗胃癌、食道癌、肝癌等适应症。市场潜力?那是相当的大!

