2017上半年总局发布有关“仿制药一致性评价”及“鼓励药品医疗器械创新”文件梳理
自2015年8月,国务院印发了《关于改革药品医疗器械审评审批制度的意见》以来,CFDA相继出台了系列政策、技术等相关文件,并逐步深化、落地。我国化学药品注册分类改革、仿制药质量和疗效一致性评价、药品上市许可持有人制度等改革的多项重点工作已经顺利开展,且诸多配套细化措施陆续出台;多个鼓励药品医疗器械创新征求意见稿的出台,初显我国鼓励创新政策导向。
仿制药一致性评价
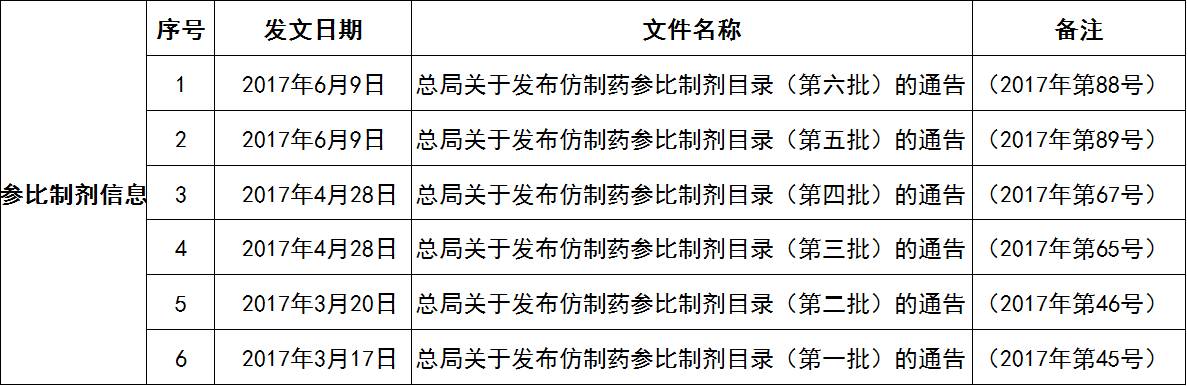
一致性评价工作涉及大量工作程序和技术性细节,包括参比制剂的确定、工作程序、临床试验要求等。2017年上半年,CFDA发布了多个技术指南正式文稿,并有新的征求意见稿出台(详见表1);此外,CFDA已公布6批仿制药参比制剂目录(详见表2),发布参比制剂共228个品规。
表1 仿制药一致性评价相关技术指导原则

表2 仿制药参比制剂目录信息
鼓励药品医疗器械创新
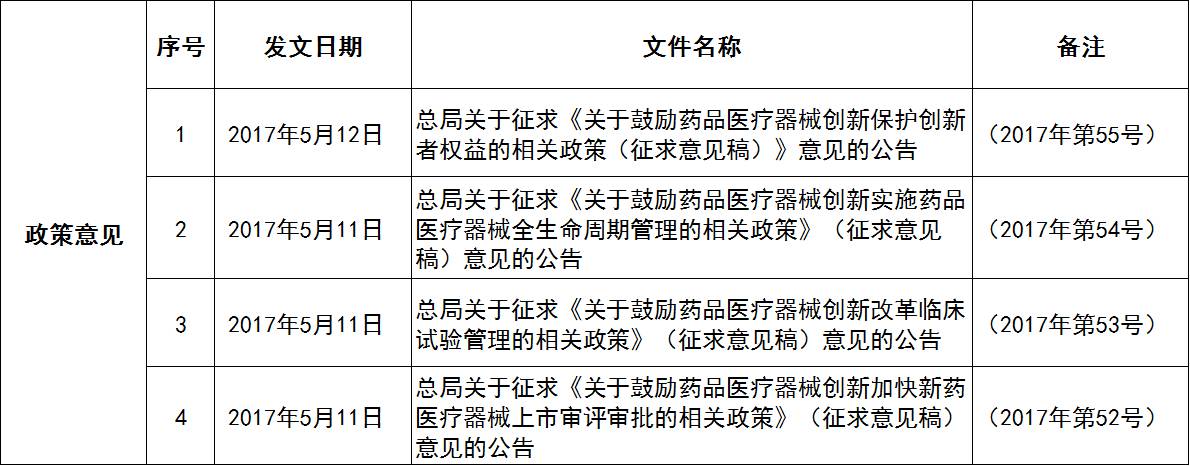
2017年5月,CFDA出台的4个征求意见稿(详见表3),聚焦鼓励我国医药创新,受到业界密切关注。若上述政策逐步进入落地实施,将大大利好我国创新医药的发展。
表3 鼓励药品医疗器械创新相关征求意见稿
总体来说,鼓励创新相关政策主要包含以下六点:
一、改革临床试验管理
1. 临床试验机构资格认定改为备案管理
2. 支持研究者和临床试验机构开展临床试验
3. 完善伦理委员会机制
4. 提高伦理审查效率
5. 优化临床试验审查程序
6. 接受境外临床试验数据
7. 支持拓展性临床试验
二、加快新药医疗器械上市审评审批
1. 加快临床急需药品医疗器械审评审批
2. 支持罕见病治疗药物和医疗器械研发
3. 严格注射剂审评审批
4. 调整药用原辅料及包装材料管理模式
5. 完善药品医疗器械审评制度
6. 支持新药临床应用
7. 支持中药传承和创新
8. 建立基于专利强制许可的优先审评审批制度
三、促进药品创新和仿制药发展
1. 建立上市药品目录集
2. 探索建立药品专利链接制度
3. 探索建立药品专利期补偿制度
4. 完善药品试验数据保护制度
5. 促进专利到期药品仿制生产
6. 落实国家工作人员保密责任
四、提升技术审评审批支持能力
1. 加强审评检查能力建设
2. 改革药品临床试验样品检验制度
3. 落实从研发到使用全过程检查责任
4. 建设职业化检查员队伍
5. 加强国际合作
五、净化药物研发生态环境
1. 严肃查处临床试验数据造假行为
2. 规范学术推广行为
六、实施药品全生命周期管理
1. 落实上市许可持有人法律责任
2. 完善药品医疗器械不良反应/事件报告制度
结语
在我国实施“十三五”深化医药卫生体制改革规划的大背景下,一系列的政策的革新和出台,核心目的就在于提高我国仿制药质量、鼓励创新药研发。
目前我国仿制药一致性评价工作正如火如荼地开展,鼓励创新政策导向也初显。当然,为了我国医药创新创造更好的环境,仍需要多方面政策机制的支持,如创新药市场准入、医保、招标、知识产权保护等配套措施,这将助力于我国医药卫生体制改革的深化。

