2017年4月份FDA批准新分子实体药物概况
2017年4月份,美国FDA共批准的新分子实体药物共计5个,详见下表。
DEUTETRABENAZINE
AUSTEDOTM(Deutetrabenazine)是FDA批准的首个氘代产品,也是获得FDA批准的针对亨廷顿舞蹈病的历史上第二个药物【首个产品为Xenazine(tetrabenazine)】。亨廷顿舞蹈症是一种罕见且致命的神经退行性疾病,在美国范围内,影响约超过3.5万病人群体。
Deutetrabenazine (原名SD-809) 是一类囊泡单胺转运体2(vesicular monoamine transporter 2,VMAT2)抑制剂。 在化学上,deutetrabenazine是tetrabenazine的衍生类似化合物,其中6个氢原子被氘原子代替。氘的掺入会降低药物代谢的速度,从而减少给药频率。作为tetrabenazine的重氢化形式,deutetrabenazine化学结构的改良显著改善了药物安全性和有效性。
VALBENAZINE
INGREZZA(Valbenazine)是首个获得FDA批准的用于治疗迟发性运动障碍(TD)治疗的药品。它是一种选择性的VMAT2抑制剂,特异性高,与VMAT1、多巴胺能受体、5-羟色胺能受体等亲和力较低,从而避免导致其他副作用。曾获得了美国FDA颁发的突破性疗法认定。
迟发性运动障碍是一种中枢神经系统疾病,症状特征是面部、躯干或四肢不自主的节律性重复运动。这往往是由于其他药物所导致。
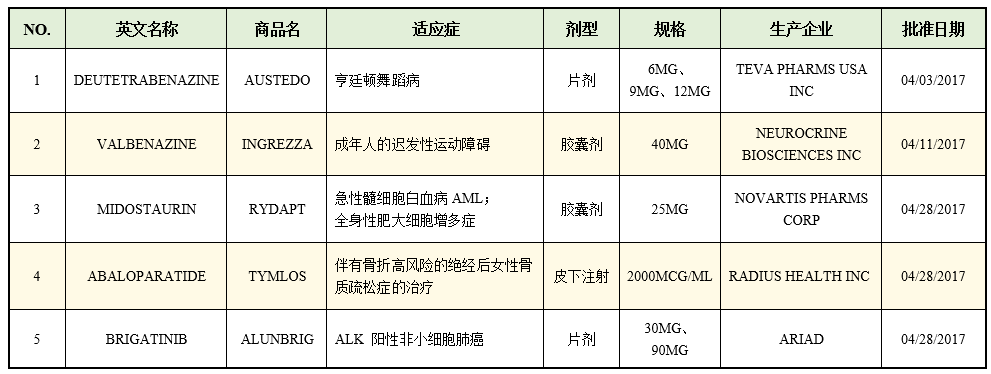
Ingrezza(Valbenazine)和Austedo(Deutetrabenazine)结构非常类似:Deutetrabenazine是外消旋混合物,二者的结构信息如下:
PDUFA:处方药申报者付费法案。PDUFA date截止日期,在此时间前FDA须对报批药物给与审评意见(通过,不通过,补充内容再考虑是否通过)。
Austedo也申请了TD适应症,其PDUFA截止日期为今年8月30日,Ingrezza的抢先上市对Austedo显然是个不利的消息。Austedo有抑郁和自杀念头的黑框警告,Ingrezza安全性也略占上风。
MIDOSTAURIN
RYDAPT (Midostaurin)是一种口服多激酶抑制剂,用于治疗携带FTL3突变的急性髓性白血病(AML)患者,是首个用于治疗AML的靶向药物。据估计,在全球范围内有35万白血病患者,其中约25%为AML。三分之一的AML患者携带FLT3基因突变。
此外,FDA还批准RYDAPT用于治疗罕见血液疾病(侵袭性全身性肥大细胞增多症)。全身性肥大细胞增多症病人有关节痛,骨痛和过敏样症状。其他还有刺激H2组胺受体所致的症状(胃酸和粘液分泌增加)。病人因此常有消化道溃疡和慢性腹泻问题。
ABALOPARATIDE
TYMLOS (Abaloparatide)是一种新型合成肽,是甲状旁腺激素受体(PTH1受体)的一种选择性激活剂,由于其具有良好的成骨活性,用于伴有骨折高风险的绝经后女性骨质疏松症的治疗。
骨质疏松是一种表面看来缺乏症状的疾病。患者往往直到骨折发生时,才会意识到自己罹患了这种疾病。据估计,美国每年约有200万起因为骨质疏松症引起的骨折事件,预计在2025年到达300万。TYMLOS为近15年来美国上市的针对这一患者群体的首款成骨类合成代谢药物。
BRIGATINIB
ALUNBRIG (Brigatinib)用于治疗对克唑替尼抵抗或不耐受的ALK阳性非小细胞肺癌患者。作为一款ALK的强效抑制剂,它能抑制ALK以及ALK融合蛋白,从而抑制肿瘤的生长。它也曾先后获得过美国FDA颁发的突破性疗法认定与孤儿药资格。

