美国FDA授予辉瑞公司lorlatinib突破性药物资格
辉瑞公司宣布,美国FDA已授予其新一代ALK/ROS1酪氨酸激酶抑制剂(TKI)lorlatinib突破性药物资格,用于既往接受一种或多种ALK抑制剂治疗、但病情进展的间变性淋巴瘤激酶(ALK)阳性转移性非小细胞肺癌(NSCLC)的治疗。
FDA授予lorlatinib突破性药物资格,是基于一项正在开展的I/II期临床研究的疗效和安全性数据。该研究受试者是既往接受了一种或多种ALK抑制剂治疗、但病情进展的ALK阳性NSCLC患者。
【关于 lorlatinib】
据Lorlatinib的临床前研究数据显示,lorlatinib在携带ALK和ROS1基因重排的肺癌模型中显示出强大疗效。Lorlatinib用于抑制对其他ALK抑制剂产生耐药的肿瘤突变,并且可以穿越血脑屏障。目前该品种处于临床2期研究阶段。
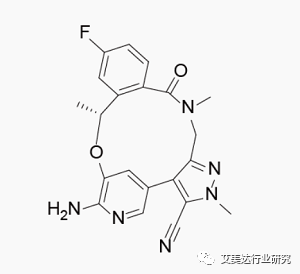
Lorlatinib化学结构式
【关于ALK阳性非小细胞肺癌的治疗】
肺癌是全球范围内发病率和病死率最高的恶性肿瘤,其中非小细胞肺癌约占80%。ALK阳性NSCLC是肺癌的一个特定分子亚型,约占全部NSCLC的3%~7%。
辉瑞公司的Xalkoi(Crizotinib,克唑替尼)是首个获批上市的ALK抑制剂,2011年获FDA批准上市,是临床上公认的用于ALK阳性晚期NSCLC的一线标准治疗药物。
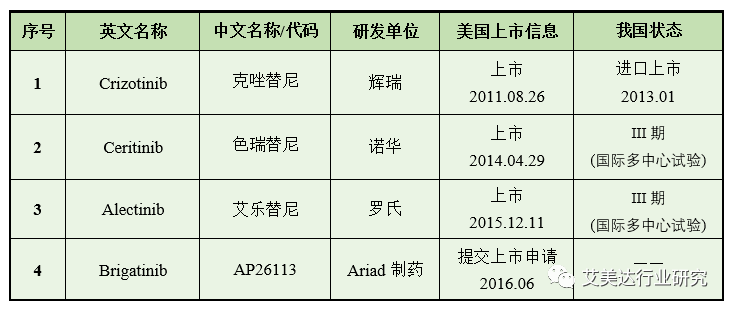
ALK阳性非小细胞肺癌的靶向治疗药物相关信息