未满足的临床需求-深入分析最具临床价值创新药产品
在2017年3月12日晚,由中国医学科学院、中国中医学科学院、中国药促会和人民网联合主办的“第二届(2016)中国医药创新品牌系列评选活动”颁奖典礼中,最终评选出五个奖项,其中最具临床价值创新药分别由微芯生物的西达本胺、上海天士力的注射用重组人尿激酶原和成都百裕的银杏内酯注射液获得。这三种最具临床价值的创新药在临床中的意义不言而喻,那么,它们在市场中能为患者带来哪些临床优势呢?
西达本胺
商品名:爱谱沙
上市时间:2014年12月
适应症:首个适应症为复发及难治性外周T细胞淋巴瘤(PTCL);实体瘤适应症(联合治疗)开发,已完成非小细胞肺癌Ⅱ期临床入组,启动乳腺癌Ⅲ期临床研究。
外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是一组高度异质性的淋巴细胞异常恶性增殖性疾病,包括来自胸腺起源的成熟T细胞及NK细胞肿瘤。PTCL的发病率具有明显的地域差异,在中国,PTCL发病例数约占非霍奇金淋巴瘤(NHL)的29.6~39.1%,显著高于欧美国家的10%~15%。据此推算,中国的PTCL年发病人数约在5万人左右,患病人数约为10万人左右(即患病率约90/百万),而且往往都是恶性程度很高、没有可行的药物可救治。
目前临床上缺乏标准药物推荐治疗手段,对常规化疗反应率低,易复发,5年总生存率仅在25%-30%间。含蒽环类药物的化疗如CHOP(环磷酰胺,阿霉素,长春新碱,泼尼松)和CHOP样方案是最常用的一线治疗方案,但疗效尚达不到满意,尤其是对蒽环类耐药的患者。因此,亟需可以改善生存的PTCL治疗方案。
目前,国际上已上市的PTCL新药有AllosTherapeutics的普拉曲沙、Gloucester-Istodax罗米地辛和Spectrum的贝利司他。普拉曲沙于2009年9月通过FDA快速审批程序,批准该药治疗PTCL的孤儿新药上市,成为全球范围内首个针对PTCL为适应症的上市新药;罗米地辛于2011年6月获得FDA批准用于二线治疗;贝利司他于2014年7月获得FDA批准用于二线治疗。
以上三个药品均尚未在国内上市,不过原研普拉曲沙已于2012年提交临床申请,并于2014年获得批件;此外,还有普拉曲沙5个3类临床申请受理号,均于2016年上半年获得批件,国内企业已经虎视眈眈。罗米地辛原研尚未在国内申请临床,但已有4个3类临床申请受理号,并于2016年获得批件。贝利司他尚未有相关临床申请。
从疾病进程和现有治疗手段上看,PTCL具有患病率低,累及人数少,属于罕见病范畴,严重缺乏综合获益良好的有效治疗药物的特征。传统的化疗治疗PTCL无法获得满意的疗效,新近在美国批准的普拉曲沙、罗米地辛与贝利司他虽然可获得一定的疗效,但安全性代价较高,且药物价格高昂,月均治疗费用高达14万~28万元,远非我国患者所能承受,而西达本胺月均费用在2万元。因此,西达本胺为中国PTCL患者带来了有效且相对安全的新型药物治疗选择,并且西达本胺制定了慈善赠药计划,帮助那些临床获益、但家庭收入较低的患者继续获得治疗。
西达本胺在CHIPEL注册临床研究中确认的主要疗效指标ORR与普拉曲沙、罗米地辛相当,西达本胺为28%、普拉曲沙为27%、罗米地辛为25%,且安全性更优。2016年CSCO年会报道的703例临床主动监测计划回收的数据分析显示,60%以上患者能够从口服西达本胺的治疗中获益,近40%患者能够进入慈善赠药阶段,大大延长复发难治的PTCL患者生存期。
注射用重组人尿激酶原
商品名:普佑克(简称:pro-UK)
上市时间:2011上市
适应症:急性ST段抬高性心肌梗死的溶栓治疗;此外,已申报临床试验增加治疗肺梗适应症。
急性心肌梗死(AMI)已成为近20年中国人群入院和死亡的主要原因。根据流行病学数据显示,我国急性心肌梗死发病率为45/10万~55/10万,并且AMI在中青年(<60岁)的发病率逐渐增加,居高不下的死亡率对社会带来的危害也同比增大。溶栓药物通过激活纤溶酶促进纤维蛋白溶解,是治疗血栓性疾病的有效药物。
溶栓药物按照研究进展可划分为三代产品,注射用重组人尿激酶原(第二代),是尿激酶(第一代)的前体,是通过基因工程方法制备的一种新型溶栓药物,用于由血栓引起的剂型心肌梗死的治疗,并有治疗外周血管血栓及由血栓引起的缺血性组织坏死类疾病的应用前景。
临床数据显示,与目前临床使用的链激酶(SK)、重组链激酶(r-SK)、尿激酶(UK)、组织纤溶酶原激活剂(t-PA)相比,具有开通率高、出血副反应小的优势。其进入血液后并无活性,但吸附在血栓表面后,经激肽酶作用被激活,转变为尿激酶,进而发挥溶栓作用,具有明显的血栓位置特异性,从而大大降低了目前许多溶栓药较为严重的出血副作用。
在艾美达全国公立医院数据库中显示,普佑克近年复合增长率高达329%,可见市场对该药物的认可度很高。
2014~2016全国公立医院注射用重组人尿激酶原购药总金额
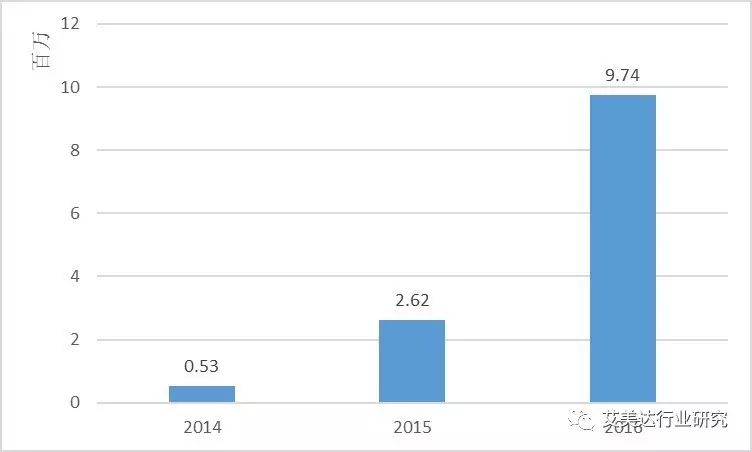
小编粗略估计,以注射用尿激酶为例对比,尿激酶治疗心肌梗死,一次治疗费用在500元左右;注射用重组人尿激酶原一次治疗费用在1200元左右。看似后者比前者的一次用药负担较大,但是在临床中,需以疾病治疗费用为评价依据,即治好一种疾病需耗费的所有成本。虽然注射用重组人尿激酶原一次性治疗费用相对较高,但可最大限度的减少心梗后的并发症,改善患者生活质量;还可以最大程度减少心脏支架手术,避免术后需长期服用氯吡格雷等抗凝血小板制剂,为患者提供安全性更高、疗效与治疗费用比更高的药物。由此看来,从注射用重组人尿激酶原获得最具临床价值创新药实至名归。
银杏内酯注射液
注册分类:中药第五类
上市时间:2011年
适应症:活血化瘀,通经活络。用于中风病中经络(轻中度脑梗塞)恢复期淤血阻络证,症见半身不遂,口舌歪斜,言语蹇色,肢体麻木等。
业内数据显示,2013年,国内医院脑血管及抗痴呆药物市场已达到225亿元,其中银杏叶制剂市场占据了20%,约为45亿元。在经历了2015年“银杏叶事件”后,2016年银杏相关药品迎来了进一步发展,年度增长率8%左右。在艾美达全国公立医院数据库中显示,2016年银杏叶相关产品购药总金额达到13亿元左右。
银杏叶相关产品众多,但是提取工艺却是考量药品质量的重要标准之一,2015年的“银杏叶事件”也是与企业擅自改变提取工艺有关,擅自改变提取工艺存在“分解药品有效成分,影响药品疗效”的风险。银杏主要有效成分是银杏内酯和银杏黄酮,传统银杏叶制剂仅含银杏内酯6%,水溶性不易透过血脑屏障的黄酮24%,其他不明成分占70%,包括银杏酸等致敏物质。此次获选最具临床价值创新药的银杏内酯注射液,明确成分达100%,有效成分达99%。
银杏内酯注射液II期临床研究结果显示,实验组对中风病(淤血阻络证)的综合疗效总进步率均显著优于舒血宁组。III期临床结果显示,实验组对中医征候总积分的改善程度优于对照组。银杏内酯注射液上市后,成都百裕进行了IV期临床试验,结果表明该药物安全有效。
在用药费用负担方面,银杏内酯注射液与其他活血化瘀中药制剂相比,治疗组住院治疗花费37592元,院外治疗费用1951元,自理患者比例89.78%;对照组住院花费38467元,院外治疗费用3756元,自理患者比例66.07%。治疗组成本效果比优于对照组,整体用药费用有一定降低。
在新版医保目录中,虽然中药品种成为最大赢家,但中药注射剂的使用有了更多的限制。银杏内酯注射液作为风口浪尖上的产品,能获得此次最具临床价值创新药实属不易。
“第二届(2016)中国医药创新品牌系列评选活动”的创新药,均有较高的临床价值,为提高患者生存质量和降低用药费用起到举足轻重的作用。
评选活动虽然落幕了,但是获奖的药品仍要面临市场准入、招标等问题。值得欣慰的是,随着国家越来越注重创新,相信那些为满足的临床需求的新药将成为医药行业的未来。

