2017年1类新药申请比以往来的都迅猛了些
经历过药品审评审批改革后的新药申请才是真正的勇士!小编汇总了2017年1~2月的1类新药申请,让我们来扒一扒这些新药的过人之处,猜一猜它们有没有潜力进入下一轮医保目录更新?
Pt(0506)101(注射用)
由北京市丰硕维康技术开发有限责任公司申报,目标适应症肺癌和胃癌。传统铂类药物一直作为癌症的经典化疗药,但其副作用和耐药性问题却不容忽视。Pt(0506)101是一种新合成的铂类化合物。据了解,Pt(0506)101在裸鼠体内对人胃癌移植瘤效果较明显,且有较低的神经毒性、免疫抑制毒性和骨髓抑制毒性,和传统铂类药物无显著交叉耐药。在艾美达全国公立医院数据库中显示,铂类药物在2016年购药总金额为19.3亿元人民币。当大部分研究者专注于靶向药物时,传统药物的研发或许能带来一丝不一样的期望。
KL070002胶囊
由四川科伦博泰生物医药股份有限公司申报,为小分子抗肿瘤药物,临床前研究数据表明:KL070002的抗瘤谱广,对胰腺癌、非小细胞肺癌、卵巢癌、胃癌、结直肠癌、前列腺癌、膀胱癌、肝癌等多种实体瘤药效明确,同时,KL070002可以口服给药,有利于提高患者用药依从性。
四川科伦博泰生物医药股份有限公司由四川科伦药业股份有限公司控股。此外,四川科伦药业股份有限公控股子公司四川科伦博泰生物医药股份有限公司研发的重组抗VEGFR2全人源单克隆抗体注射液(受理号:CXSL1600119,注册类型:2类)、四川科伦药业股份有限公司全资子公司四川科伦药物研究院有限公司开发的注射用多西他赛(白蛋白结合型)(受理号:CXHL1600320,注册类型:2.2类)和环孢素脂肪乳注射液(受理号:CXHL1600269,注册类型:2.2类)已获CDE承办。也就是说,四川科伦药业在2017初便连续申报了1种1类新药,3种2类新药。科伦药业创立于1996年,是拥有32家子(分)公司的药业集团。2010年6月3日,科伦药业在深圳证券交易所成功上市。
丹诺瑞韦钠(片)
由歌礼药业申报,是一种治疗丙肝的口服创新型药物,丹诺瑞韦临床的三联方案治疗中国基因 I 型丙肝患者 12 周,治愈率超过95%。丹诺瑞韦钠在2014年初首次申请临床,在2017年便开始申报上市生产,研发速度令人惊叹,是本次统计时间内唯一一个上市申请的1类新药。目前该药物进入优先审评,有望成为中国第一个获批上市的丙肝治疗药物。
目前治疗丙肝的方法主要有两种,一种是聚乙二醇干扰素合并利巴韦林,疗程持续一至两年。但是近一半的患者不耐受干扰素,会出现骨髓抑制和溶血、肾脏损害、精神异常等副作用,而适用干扰素的患者也仅有60%左右能被治愈。
另一种是口服小分子抗病毒药物,疗程仅12周,治愈率达90%以上,且适用干扰素不耐受人群,在欧美已成为主流治疗方法。但这一领域被国际药业巨头垄断且价格昂贵。以美国吉利德公司的药物为例,其在美国的售价为84000美元一疗程,相当于一天1000美元,总价折合人民币约50万元。2015年吉利德丙肝药物销售额突破192亿美元。
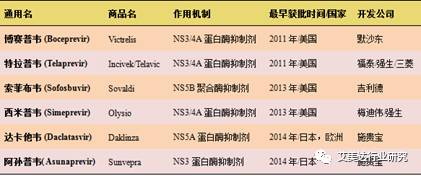
近年来上市的丙型肝炎直接抗病毒药
在部分国家或地区获批的抗丙肝病毒“鸡尾酒”复方制剂
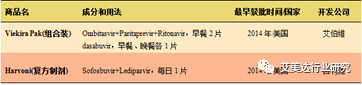
然而国内目前尚无小分子抗病毒药物上市,临床采用的依然是聚乙二醇合并利巴韦林的疗法。尽管这些药物还没有在我国上市,但部分已经在我国开展的临床试验。据艾美达公共数据库显示,索非布韦共有42个受理号,其中40个已发批件,涉及22个制药企业,该药物原研吉利德在华申请的索非布韦化合物基本专利有效期到2024年;达卡他韦共有9个受理号,其中7个已发批件,涉及4个制药企业,该药物原研施贵宝在华申请的达卡他韦化合物基本专利有效期到2027年。
由此可见,我国仿制药企业虎视眈眈,不过涉及这么多制药企业,在一致性评价的大环境下,有多少企业能够花血本助推仿制药上市有待观察。
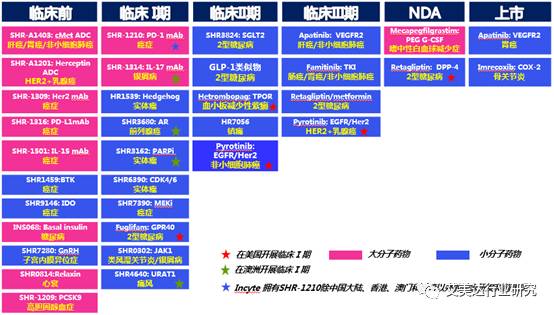
SHR1459和SHR-1316注射液
由江苏恒瑞申报SHR系列药物,目标适应症为癌症。艾美达推测SHR1459为小分子靶向药物,具体不详。恒瑞作为国内抗肿瘤药物研究的龙头老大,抗肿瘤药销售额在国内排名第一。新药产品研发管线非常丰富。
SY-008(胶囊)
由苏州亚宝药物研发有限公司申报,用于治疗II型糖尿病的新型口服药物。该药物是亚宝与美国礼来制药公司合作开发,目前尚无与该新药具有相同靶点的同类药物上市。截止到去年年底,亚宝已对SY-008的研发投入约719万元人民币。
数据资料显示,在全球范围内2013年糖尿病药物的销售金额为363.2亿美元,其中胰岛素所占比例最大,为57.3%。到2019年时预计糖尿病药物销售金额达到601.1亿美元,而此时胰岛素所占比例却有所下降,为48.2%,新机制药物包括DPP-4抑制剂、GLP-1激动剂以及SGLT-2抑制剂在非胰岛素类药物中的市场份额将显著增长(78.5%增至90.5%)。此外,还有更新的其他机制药物在活跃,如葡萄糖激酶激活剂、G蛋白偶联受体119、GPR119激动剂、PTP-1B抑制剂、GPR40激动剂和11β-HSD1抑制剂等。
注射用APG-1387
由广州顺健生物医药科技有限公司和江苏亚盛医药开发有限公司联合申报,艾美达推测其目标适应症为鼻咽癌和乳腺癌。早在2013年6月,江苏亚盛已申报过临床,在2014年12月审批完毕,目前处于临床I期试验。此次,江苏亚盛联合广州顺健生物医药再次共同申报APG-1387临床,能否通过让我们拭目以待吧。
ZSP1603(胶囊)
由广东众生药业股份有限公司申请,与上海药明康德新药开发有限公司共同研发,主要用于治疗特发性肺纤维化(IPF)和恶性肿瘤。治疗IPF目前仅有两个药物获批上市,分别是罗氏的吡非尼酮和勃林格殷格翰的尼达尼布。GlobalData数据显示2015年IPF全球市场为 9.07亿美元,预计2025年将达到32亿美元。目前,仅有吡非尼酮(2011年获批CFDA上市)和尼达尼布(2014年获得FDA批准上市)上市,价格昂贵,治疗费用较高。
据众生药业介绍, ZSP1603临床前研究显示,其对IPF及恶性肿瘤均有较好活性。有研究结果显示IPF患者的肺癌发病率为4.4%~48.2%,显著高于普通人群的2.0%~6.4%,大多数研究结果显示IPF患者的肺癌发生风险比普通人群增加7~14倍,在IPF患者死因中可达10%。因此,ZSP1603一旦成功上市,对于IPF、实体肿瘤的治疗将是一个巨大的突破,市场前景广阔。
泰瑞拉奉(注射用)
由南京中瑞药业有限公司申报,主要用于预防和治疗因血小板高聚集状态引起的心、脑及其它动脉的循环障碍疾病。泰瑞拉奉以已上市脑神经保护药依达拉奉(Edaravone)作为先导化合物,运用me-too/me better新药开发策略,基于依达拉奉结构进行合理药物设计,设计目的在于提高此类化合物消除氧自由基能力。艾美达全国样本公立医院数据库显示,依达拉奉2016年销售额为15.7亿,泰瑞拉奉能否抢占大蛋糕,需要市场的检验。
重组人源化抗PD-1单克隆抗体注射液
由泰州翰中生物医药有限公司、杭州翰思生物医药有限公司和中山康方生物医药有限公司联合申请。2015年卫计委重大新药创制专项已明确将PD-1、PD-L1等列为重要靶点,为当年国家重大新药创制专项新动向。目前国内已有许多公司或学术机构正在进行anti-PD1、anti-CTLA4单抗的临床前研究,也有企业已进入申报临床阶段。其中,恒瑞PD-1单抗注射用SHR-1210进入审批绿色通道,目前处于在审评阶段。
对于PD-L1,艾美达公共数据库显示,苏州康宁杰瑞生物科技有限公司和四川思路迪药业有限公司合作开发的重组人源化PD-L1单域抗体Fc融合蛋白注射液在去年5月份提交CDE临床申请。基石药业(苏州)有限公司和拓石药业(上海)有限公司合作开发的重组抗PD-L1全人单克隆抗体注射液在去年10月份提交CDE临床申请。两个产品均处于在审评状态。(感兴趣的小伙伴们可以阅读:PD-1/PD-L1抗体---国内外企业势均力敌?)
又有新的企业加入到PD-1/L1的研发阵营中,谁能抢先上市在此时则显得尤为重要。
硝酸铵(注射液)
由甘肃玉璞肿瘤心血管病研究所申报,据该申报人表示,其具有增强免疫功能,与化疗药物可协同杀灭癌细胞,并降低化疗毒性的作用。该药物最早在2004年4月申报临床申请,已过13个年头,从CDE中三进三出,送走了多少CDE评审员......本次2017年1月再次提交临床申请,精神可嘉!
此外,还有部分1类新药申请尚不清晰目标适应症。
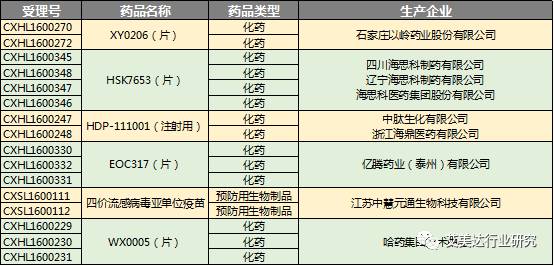
这些新药中,进度最快的便是歌礼药业丹诺瑞韦钠(片),并且获得优先评审资格,上市销售指日可待。在国内尚未有同类药品的情况下,丹诺瑞韦钠的市场潜力巨大~
历经药品审评审批改革后,创新方是制药企业长久发展,相信未来会有更多的1类新药涌现。

