“史上”最全FDA新药注册解读—在这里读懂NDA!(下)
昨天,艾美达与各位微友分享了FDA新药申请流程上半部分,本期小编将继续和大家分享交流FDA新药注册流程(NDA,New Drug Application)(下)。
3、临床试验
如果FDA批准IND申请,临床试验(由人类受试者参与的研究)可以开始。
1期临床:严格控制药物在少量的健康志愿者身上进行,大约有20—80例。这阶段的试验主要是获得药物的基本的安全性数据、以及药理信息。受试者一般为健康志愿者。
2期临床:试验药物在一小部分受试者身上进行,大约为100到200例。这些病人是患有该药物预设所治的疾病。这个阶段进一步提供了该药的安全性数据,用于建议用途的第一个适应症使用该试验药的有效性。如果药品申办者能够从该药的使用、或之前的临床研究得出结果该药用于临床是安全的话,一期临床甚至某些情况下的二期临床可以省去。
3期临床:参与受试者有数百人到数千人,重点考察药物的安全性和有效性。试验药物在较多的受试者之间进行,这些受试者患有该药物预设所治、诊断、预防等的疾病。在开始本阶段研究之前,药品申办者必须向FDA提交从一、二期临床试验中的数据以表明该药是有理由安全、有效的以及具有有利的效益/风险比。
End of Phase IIA meeting(EOP2A)
在II期临床试验完成以后,FDA强烈建议申请人在开始III期关键性临床试验之前,提出EOP2会议。
EOP2A会议发生在临床试验获得在拟定适应症中的剂量反应关系后,包括剂量范围对安全性、生物标志物和概念性验证的影响;通常发生在I期临床试验完成和第一批患者暴露-反应试验之后和IIb期(如患者剂量范围试验)和III期临床有效性安全性试验之前
EOP2A有助于帮助申请人找到最佳剂量,节约成本,将后期临床试验的成功率最大化。
为了能够充分利用EOP2会议与FDA进行沟通,在会议开始一个月之前,申请人应向FDA提交一个会议文件包:
1.会议请求& 会议信息(60天): Y or N
2.日期、时间和参会者
3.总结所有更新的数据 (临床, CMC, 药理/毒理等)
4.提出 Phase III 开发计划
5.提出可能使用的药物标签
6.问答
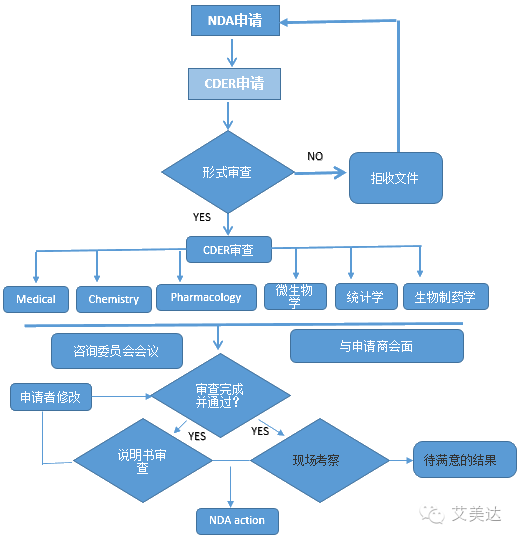
4、新药申请 (NDA)
临床试验结束之后,药物申请者可提交一份 NDA,申请批准这款药物在美国销售。FDA根据药品的治疗特性,在审查程序上分为“标准审查(Standard Review,SR)”和“优先审查(Priority Review,PR)”两类。对“能够在治疗、诊断或疾病预防上比已上市药品有显著改进的新药”,FDA 对非常重要的 NDAs 在 6个月内进行审评,新药的标准审评时间是 10 个月。FDA根据《政策和程序手册》(Manual of Policies and Procedures,MAPPs)相关规定可采取“优先审查”(Priority Review),评审时间由标准审查的10个月缩短为6个月。
NDA评审是最严格、耗时的过程,而且只有很小比例的试验药最终能允许进入了市场。
此外,FDA还通过快速通道(FastTrack)来鼓励药物创新和加快审查用于治疗严重或威胁生命疾病或尚未满足临床治疗需求的新药,例如艾滋病、阿尔兹海默病、心衰、肿瘤、癫痫、抑郁症和糖尿病等。一旦符合快速通道(Fast Track)的药品,FDA必须在60天内做出决策。
新药上市后的监测
药物被批准之后,药品的标签可能进行变更,内容包括药物副作用的新信息。药物申请者需要提交安全性变更,医生或患者也可以向 FDA报告有关药物的严重不良事件。引起更严重、超出预期副作用的药物在必要的情况下要从市场撤市。
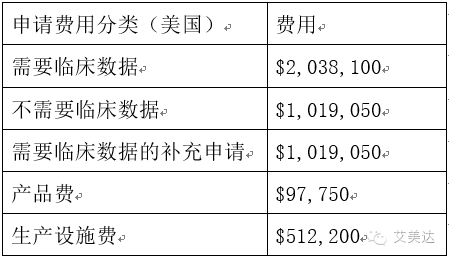
NDA申请费用——PDUFA
PDUFA即《处方药申报者付费法案》,FDA依据该法案向制药商/申报者收取一定的审查费用。
PDUFA费用主要包括三部分:1、申请费 2、生产设施费 3、产品费
法案同时也规定,PDUFA费用只针对新药申请阶段(NDA)收取有关费用,而对于临床前研究(Pre-IND)申报资料的审评,是不收取有关费用的。
费用的免除、削减和退还
PDUFA条款中也指出,当免除费用的决定有助于公众健康和安全、费用收取会给药品创新带来障碍、或者所收费用超过审查成本时,FDA可做出免除、削减或退还收费的决定。

