一致性评价背景下仿制药在FDA注册流程—ANDA注册流程解读
今年三月,国务院印发了《关于开展仿制药质量和疗效一致性评价的意见》,随着意见的出台,中国仿制药的“寒冬”也随之而来,开展一致性评价无疑会给药企带来沉重的负担。然而意见中有明确提出:
国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;在中国境内用同一生产线生产上市并在欧盟、美国和日本获准上市的药品,视同通过一致性评价。
这无疑是为中国药企指明了另一条明确的道路,鼓励国内企业走向国际。国内企业转向更清晰明朗的FDA、欧盟等其他国家的认证,也许是更好的选择。
今天,小编就介绍一下FDA新药简略申请(ANDA,Abbreviated New DrugApplication)管理制度及注册流程,以便让大家更好地了解美国仿制药相关法律法规及流程。
ANDA申请
ANDA申请即仿制药申请,仿制药申请被称为“简略申请”,是因为它们基本上不需要临床前资料(动物实验)和临床资料(人体实验)来建立安全性的有效性。仿制药申请者必须要科学地 论述他们的产品是生物等效的(也就是,和原创药同样的性能表现)。
根据美国《食品、药品和化妆品法》(FDCA)及美国联邦管理法21 CFR Part 21,新药申请(New Drug application)获批上市4年后的第一天,也就是专利期过后的通用名药均按此程序申请上市。第1家申请并成功获得首仿药资格的,可获得180天的市场独占保护。在这一天提交申请的仿制药厂可以共享这180天的独占期,而在这一天以前提交的ANDA申请都不会被受理。
但是,《药品价格竞争和专利期恢复法(Waxman-HatchAct)》并不适用于生物制品,即生物制品不能按ANDA批准上市。迄今已有不少试图争取生物制品仿制的游说,但尚无相关法律出台。
ANDA申请人资格
ANDA的申请人可以是“任何人”(any person),即原则上不必是公司(法人),也不区分国别,而且,ANDA的申请人和有关的《公民请愿书》请愿人均可是非美国公民。但在实际操作上,ANDA应该有足以处理问题的美国代理人,与FDA保持联络,处理注册事宜。
拟注册药品的资格
拟向FDA申请ANDA的药品,应为已被FDA批准上市的,仿制药在剂型,剂量,服用方式,质量,性能特征和用途方法都是和原创药物相当,在《经治疗等同性评价批准的药品(橙皮书)》中收载并指定参比制剂(Reference Listed Drug)的药品。
如申请人拟仿制在《橙皮书》中收载但并未制定参比制剂的药品,须先提交《公民请愿书》请求FDA将该药品指定为参比制剂。
拟申请ANDA的药品,其活性成分、剂型、规格、给药途径、适应症必须与参比制剂相同,若拟申请ANDA的药品的上述条件与参比制剂不同,则需先递交有关《公民请愿书》,获得FDA批准之后,方能提出ANDA申请。
拟申请ANDA的药品,必须与参比制剂具有生物等效性。(把生物等效性作为批准仿制药的基础是根据1984年的"药品价格竞争和专利恢复法案,",来确立的。法令通过允许FDA批准品牌药的仿制版本的上市而无需进行昂贵和重复性的临床试验来加快较便宜的仿制药的获得。)品牌药在改变配方时也要进行和仿制药一样的生物等效性实验。
拟申请ANDA的药品,必须按照美国联邦管理法21 CFR遵行药品生产管理规范控制生产过程。
生物等效性论证方法
科学家论证生物等效性的一种方法就是测定仿制药到达24-36位健康志愿者血流中的时间。这个实验给出仿制药的吸收率(rate of absorption)或者生物利用度,因此仿制药就可以凭此与原创药进行比较。仿制药必须和原创药在同样的时间内将同样量的活性成分传输到患者的血流。
ANDA申请流程
如下图所示:
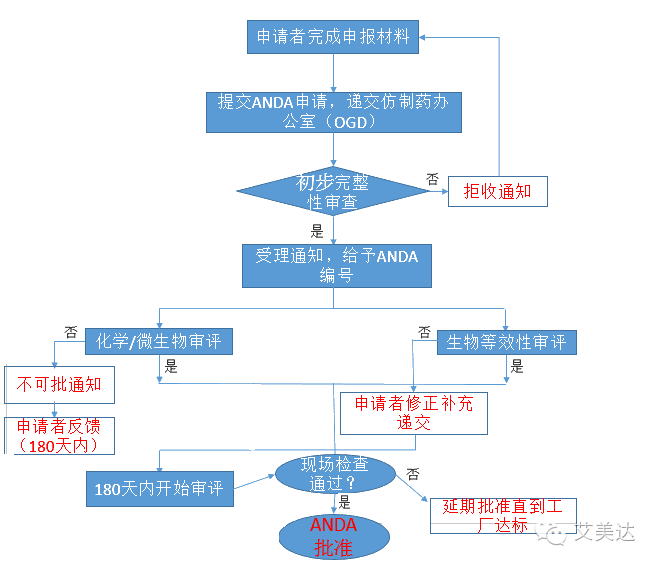
在现场检查时会收到FDA的483 缺陷表格,回复必须对每一项内容做出称述和并表示同意,提出修正时间表或提出澄清,回复必须在15天内递交FDA。
ANDA申请一旦提交,FDA一般需在180天内“review”,并给出“approved”、“approvable”(tentativeapproval)或"not approvable"的通知。
生物等效性(BE)评审:FDA 要求申请者提供信息证明生物等效性,
包括:
成分对比
比较性的溶出实验
人体内的生物等效性
有效性比较评估
化学/微生物评审
保证仿制药的生产将控制在一定的稳定范围中 Provides assurance that the generic drug will be manufactured in acontrolled consistent manner
评审范围:
生产过程
原料规格和控制
消毒过程和验证
容器系统
稳定性
简略新药申请(ANDA)所包括的资料被交至FDA药品评审和研究中心所属的仿制药办公室,用于仿制药的评审和最终批准。一旦批准,则申请者可以生产和销售该仿制药以向美国公众提供安全,有效,廉价的替代品。
本文只针对一致性评价背景下仿制药在FDA的申请流程,至于FDA的NDA(New Drug application)——新药申请,小编将在接下来的几期中做另外的阐述。
为了更好地理解,小编从FDA官方网站选取了部分原文。
FDA原文:
An Abbreviated New Drug Application (ANDA) containsdata which when submitted to FDA's Center for Drug Evaluation and Research,Office of Generic Drugs, provides for the review and ultimate approval of ageneric drug product. Once approved, an applicant may manufacture and marketthe generic drug product to provide a safe, effective, low cost alternative tothe American public.
A generic drug product is one that is comparable to aninnovator drug product in dosage form, strength, route of administration,quality, performance characteristics and intended use. All approved products, both innovator andgeneric, are listed in FDA's Approved Drug Products with TherapeuticEquivalence Evaluations (Orange Book).
Generic drug applications are termed"abbreviated" because they are generally not required to includepreclinical (animal) and clinical (human) data to establish safety andeffectiveness. Instead, genericapplicants must scientifically demonstrate that their product is bioequivalent(i.e., performs in the same manner as the innovator drug). One way scientistsdemonstrate bioequivalence is to measure the time it takes the generic drug toreach the bloodstream in 24 to 36 healthy, volunteers. This gives them the rate of absorption, orbioavailability, of the generic drug, which they can then compare to that ofthe innovator drug. The generic versionmust deliver the same amount of active ingredients into a patient's bloodstreamin the same amount of time as the innovator drug.
Using bioequivalence as the basis for approvinggeneric copies of drug products was established by the "Drug PriceCompetition and Patent Term Restoration Act of 1984," also known as theWaxman-Hatch Act. This Act expedites the availability of less costly genericdrugs by permitting FDA to approve applications to market generic versions ofbrand-name drugs without conducting costly and duplicative clinical trials. At the same time, the brand-name companiescan apply for up to five additional years longer patent protection for the newmedicines they developed to make up for time lost while their products weregoing through FDA's approval process. Brand-name drugs are subject to the samebioequivalence tests as generics upon reformulation.

