双抗研发“竞速赛”,谁能抢得先机?
古罗马诗人奥维德曾言:“一匹马如果没有另一匹马紧紧追赶并要超过它,就永远不会疾驰飞奔。”这就是竞争的重要性。
在PD-1单抗内卷、差异化竞争策略的刺激下,双抗已经成为研发热门赛道。
随着国内双抗药物研发即将迎来收获期,究竟谁能在这场“竞速赛”中抢得先机?让我们一睹为快。
全球仅有4款双抗药物上市
如果说,PD-1单抗开启了肿瘤免疫治疗1.0时代。那么,双抗就是即将引领肿瘤免疫治疗2.0时代的“硬通货”。
医学技术发展至今,治疗癌症的方法已经涵盖了手术治疗、化疗、放疗、免疫治疗、靶向药物治疗(小分子靶向药、单抗)等,但这些治疗方法都存在一定的局限性。
基于此,第四代肿瘤治疗组合药物——双抗、ADC药物乘势而起,成为创新药企业的必争之地。
被称为“生物导弹”的ADC药物,集化疗药物的杀伤力和精准疗法的特异性于一身,能有效实现精准杀伤肿瘤细胞;而相比于仅能实现单靶向治疗、对肿瘤杀伤作用较为有限的PD-1单抗,在联合疗法的基础上建立起来,且可以实现双靶向的双抗药物,临床优势更大。

双抗与单抗对比 资料来源: Nature Review,中信建投
双抗(全称双特异性抗体),顾名思义,就是指可以同时结合两个或两个以上不同的表位或抗原的抗体,能够协同实现或提高疗效的作用。
因此,相较于单抗,可以实现双靶向治疗的双抗,不仅特异性更强、更能准确靶向肿瘤细胞并降低脱靶毒性,还能有效防止耐药、降低治疗成本、提升患者用药可及性,达到1+1>2的治疗效果。
不过,由于增加了一个特异性抗原结合位点,使得双抗药物的开发复杂性更高,技术壁垒更高,对于技术平台和靶点选择的适配性要求更高。
回溯过往,双抗已经有六十多年的技术发展史。
双抗概念于1960年被首次提出。此后,双抗的发展经历了论证双抗临床应用、发现天然人IgG4样双抗、开创DVD-Ig结构双抗以及临床研究等多个阶段。
直到2009年4月,Trion研发的用于治疗恶性腹水的双抗药物catumaxomab(靶点:CD3,Epcam)被EMA获批上市,全球首个双抗药物诞生。
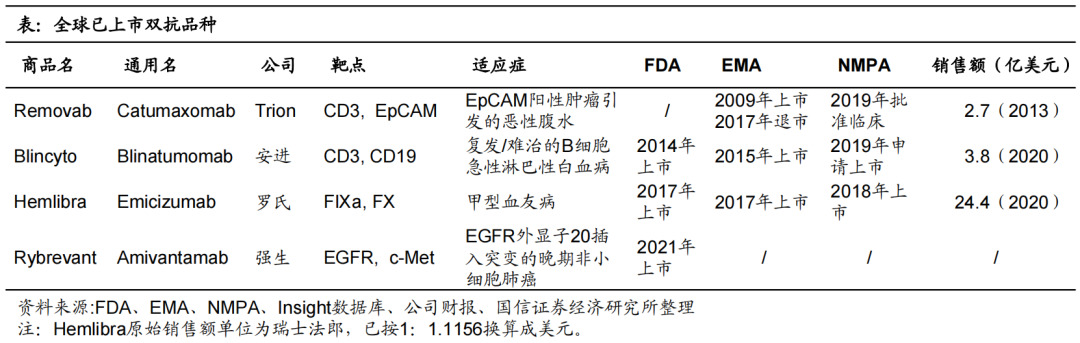
然而,双抗药物的开发复杂性和技术壁垒非常高。截至目前,全球仅有4款双抗药物获批上市。
除了Catumaxomab因销售不佳及副作用等原因于2017年退市以外,另外三款FDA批准的双抗药物分别是:安进的Blincyto(2014年获批,靶点:CD3/CD19)、罗氏的Hemlibra(2017年获批,靶点:FIX/FX),以及强生的Rybrevant(2021年获批,靶点:EGFR/cMET)。
双抗战线争夺战打响
虽然双抗药物开发难度高、上市较少,但也诞生了“重磅炸弹”药物:罗氏研发的Hemlibra,凭借注射频次少、没有生成VIII因子抑制物的风险等优势,2020年全球销售额高达24.3亿美元。
广阔的市场前景,无疑掀起了双抗研发的高潮。
国外方面,起步较早的罗氏、安进、Janssen和Merus等,凭借其强劲的研发实力,成功建立了多个双抗技术平台,布局了丰富的双抗研发管线。
阿尔文·托夫勒有言:“如果你没有战略,你就会成为别人战略的一部分。”除了自主研发以外,跨国制药巨头也在通过License in(授权引进)模式,快速抢占双抗赛道。
例如,2015年9月,安进斥资17亿美元向Xencor引进了6款双抗;2021年5月,百时美施贵宝以15.6亿美元引进Agenus研发的TIGIT双抗AGEN1777;2021年10月,强生斥资12.88亿美元,与Xencor达成一项全球独家合作和许可协议,共同合作开发和商业化CD20/CD3双抗Plamotamab,和一款通过与CD28共刺激受体结合有条件激活T细胞的新型双抗。
与此同时,虽然我国双抗研发起步较晚,但国内药企蜂拥而至。根据企业官网及CDE数据查询,目前国内已有26家企业布局了双抗疗法,共有65个双抗类产品在研(含自主研发、合作引进),涉及了多个靶点。
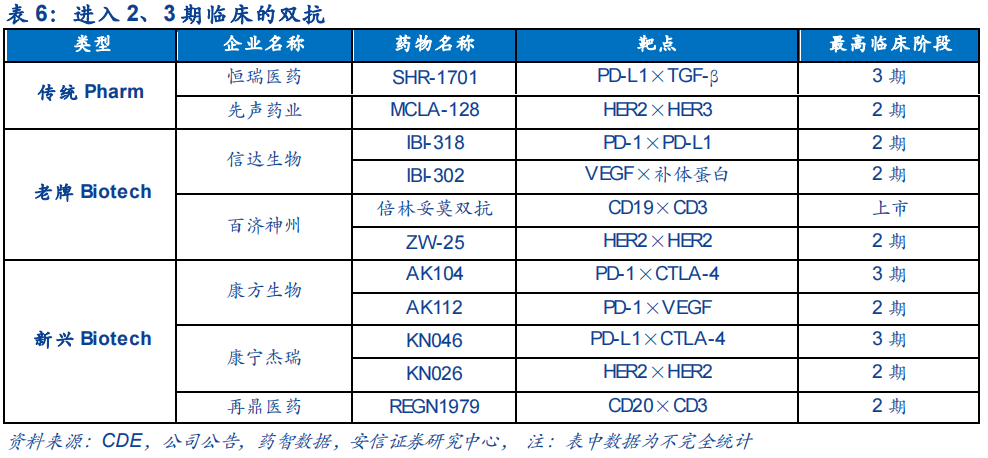
特别是在PD-1单抗内卷、差异化竞争策略的刺激下,无论是恒瑞医药、先声药业等传统Pharm,还是贝达药业、信达生物、百济神州等老牌Biotech,亦或是康方生物、康宁杰瑞、友芝友生物等新兴Biotech,都一一涉足了双抗领域。
例如,百济神州2018年从Zymeworks引进两款HER2靶向的双抗药物ZW25、ZW49,2020年1月又与安进达成全球肿瘤战略合作,负责安进在中国已获批或已申报的三款肿瘤药物安加维®(XGEVA®)地舒单抗注射液、KYPROLIS®注射用卡非佐米和 BLINCYTO®注射用倍林妥莫双抗在中国的商业化和开发,同时共同开发20款安进抗肿瘤管线药物。
擅长license in模式的再鼎医药,近年来也引进了不少双抗药物,包括再生元的CD3/CD20双抗REGN1979、Macrogenics的多款双抗药物等。
除此以外,作为国内极少数拥有双抗技术平台的康宁杰瑞、康方生物,凭借其先发优势,也得到了资本市场的青睐。
康宁杰瑞利用其建立的电荷排斥诱导双特异性平台(CRIB),开发了2价HER2-HER2不对称全长型双抗KN026。同时,还布局了KN046(PD-L1×CTLA-4)、KN052(PD-L1×OX40)、KN062、KN053、KN055、KN058等一系列双抗药物。
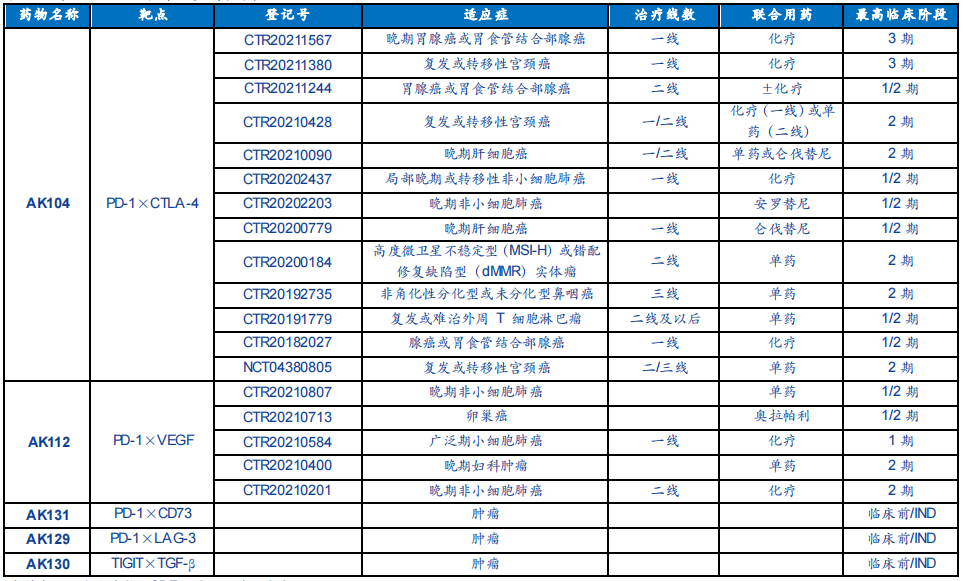
康方生物在专有的Tetrabody技术平台基础上,也开发了AK104(PD-1×CTLA-4)、AK112(PD-1×VEGF)、AK131(PD-1×CD73)、AK129(PD-1×LAG-3)、AK130(TIGIT×TGF-β)等5款双抗药物。
康方生物双抗管线及其进展 资料来源:康方生物,CDE,安信证券研究中心
国内双抗研发“竞速赛”,谁能抢得先机?
所谓“兵贵神速”。目前国内研发进度较快的双抗药物,包括:百济神州引进自安进的倍林妥莫双抗(CD19×CD3)已经在国内获批上市;康方生物的AK104、康宁杰瑞的KN046、恒瑞医药的SHR-1701等也在加快推进商业化上市。
倍林妥莫双抗(商品名:Blincyto)
Blincyto是安进基于其先进的双特异性T细胞衔接系统(BiTE)开发,能够通过将肿瘤细胞上的CD19蛋白呈递给T细胞特异表达的CD3蛋白,进而激活免疫系统识别并杀灭肿瘤细胞。
2014年12月,Blincyto获得美国药监局(FDA)批准上市,用于治疗复发/难治性B细胞ALL患者,是FDA批准的首款通过人体T细胞来毁灭白血病细胞的药物。
2020年12月7日,注射用倍林妥莫双抗在国内获批上市,用于治疗R/R前B细胞急性淋巴细胞白血病(ALL)成年患者。根据此前安进和百济神州的合作,该品种在中国上市后的商业化将由百济神州负责。
值得一提的是,Blincyto 2019年全球销售额达到3.12亿美元,2020年达到3.8亿美元,商业化前景可期。
AK104
Cadonilimab(AK104)可同时靶向两个经过验证的免疫检查点分子:程序性细胞死亡蛋白1(PD-1)及细胞毒性T淋巴细胞相关蛋白4(CTLA-4),显示出PD-1及CTLA-4单抗联合疗法的临床疗效以及PD-1和CTLA-4单抗联合疗法无法提供的良好安全性。AK104开展的适应症研究,包括宫颈癌、肝癌、肺癌、胃癌、肾癌、食管鳞癌及鼻咽癌等。
8月23日,国家药监局(NMPA)药品审评中心(CDE)同意受理AK104用于治疗复发或转移性宫颈癌的上市申请,并获优先审评。此前,AK104治疗宫颈癌已获得美国FDA授予的快速审批通道资格(FTD)和孤儿药资格(ODD)认定。
目前,全球尚无PD-1靶向的双抗药物获批上市,如果顺利获批,AK104将成为基于PD-1双抗的“first-in-class”新药。
KN046
KN046是康宁杰瑞自主研发的全球性首创重组人源化PD-L1/CTLA-4双抗,其创新设计包括:采用机制不同的CTLA-4与PD-L1单域抗体融合组成,可靶向富集于PD-L1高表达的肿瘤微环境及清除抑制肿瘤免疫的Treg。
KN046在澳大利亚和中国已开展覆盖非小细胞肺癌、胸腺癌、胰腺癌、肝癌、食管鳞癌、三阴乳腺癌等10余种肿瘤的近20项不同阶段临床试验,试验结果显示出良好的安全性和有效性。美国FDA基于在澳大利亚和中国取得的临床试验结果,批准KN046在美国直接进入Ⅱ期临床试验。目前KN046的四项注册临床试验正在进行中。
2020年9月,KN046获得美国FDA授予孤儿药资格,用于治疗胸腺上皮肿瘤。2021年10月,KN046 II/III期临床试验在中国内地成功完成首例患者给药。目前,康宁杰瑞在选择适应症时采用快速/率先上市方法,且计划于2022年中在中国提交KN046的首个生物许可证申请。
SHR-1701
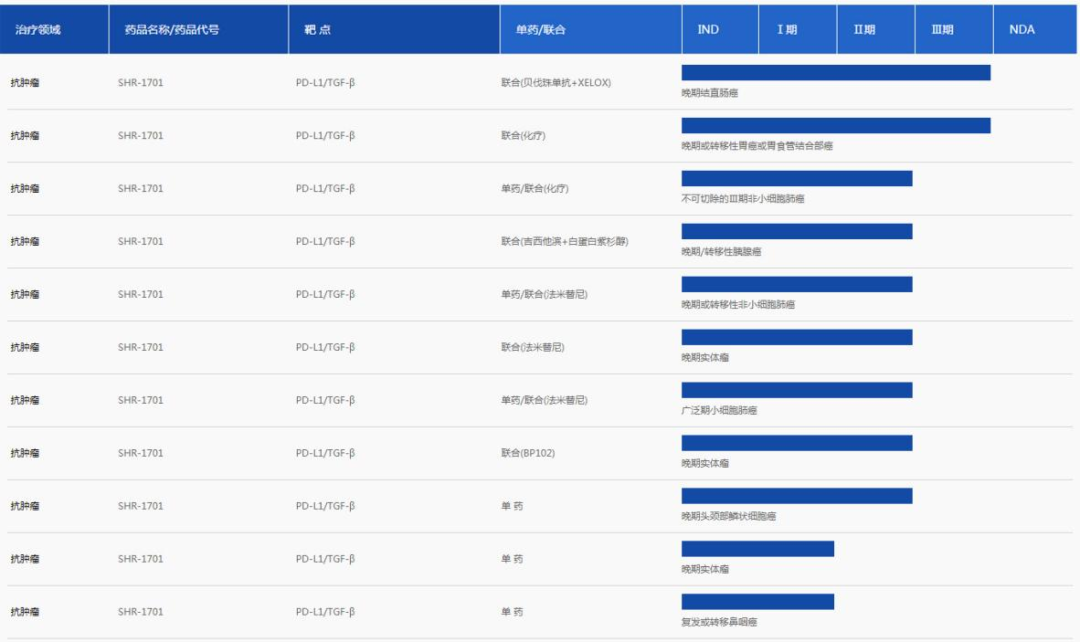
SHR-1701是恒瑞医药研发的PD-L1×TGFβ双抗,可以促进效应性T细胞的活化,同时还可有效改善肿瘤微环境中的免疫调节作用,最终有效促进免疫系统对于肿瘤细胞的杀伤。PD-1和TGF-β负信号的共同抑制可带来比单独途径抑制更加有效的抗肿瘤免疫应答,从而达到增加抗肿瘤疗效的目的。
目前,SHR-1701已经有两个适应症进入Ⅲ期临床阶段,分别为联合(化疗)一线治疗晚期或转移性胃癌或胃食管结合部癌、联合(贝伐珠单抗+XELOX)一线治疗晚期结直肠癌。
恒瑞医药SHR-1701研发进度 来源:公司官网
结语
总结来看,在创新药内卷的背景下,国内双抗药物研发“竞速赛”的战况变得更加激烈。
随着国内双抗药物研发进度的不断加快,预计未来几年即将迎来收获期,能在这场博弈中抢得市场先机的药企,无疑更受资本市场的青睐。
参考资料:
1、中信建投、国信证券、安信证券研报
2、百济神州、康方生物、康宁杰瑞、恒瑞医药等官网、财报、公告

