全球首个皮下注射药物获批,PD-(L)1单抗的故事还能续写多久
11月25日,NMPA官网显示,由康宁杰瑞自主研发的恩沃利单抗注射液(靶点:PD-L1)上市申请(受理号:CXSS2000060)已获批。成为全球首款皮下注射PD-L1单抗,也是首款国产PD-L1单抗。
同时早在获批之前康宁杰瑞就恩沃利单抗注射液与思路迪医药和先声药业达成商业合作,由思路迪医药负责其肿瘤适应症全球临床开发及商业化,先声药业负责中国大陆的商业化推广。
此次上市以Ⅱ期临床作为获批依据,其适应症为既往标准治疗失败的微卫星不稳定(MSI-H)结直肠癌、胃癌及错配修复功能缺陷(dMMR)的晚期实体瘤。此前,恩沃利单抗已被FDA授予胆管癌孤儿药认定。
恩沃利单抗还有哪些适应症
目前恩沃利单抗注射液除此适应症之外在国内还有多个临床试验正在开展,主要还是针对肿瘤领域,其中最高进度为胆道癌,除此之外关于非肿瘤的适应症(脓毒症)也开始了Ⅰ期临床试验。

全球上市的PD-(L)1单抗数量繁多
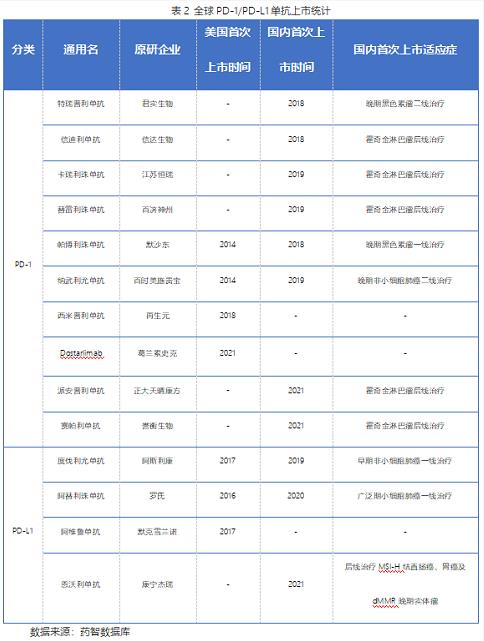
算上此次上市的恩沃利单抗,当前全球已上市的PD-(L)1单抗已经达到了14个,在国内上市的有11个,包括8个PD-1单抗和3个PD-L1单抗。
国内上市的产品中,本土企业的产品有6个PD-1单抗和1个PD-L1单抗。PD-(L)1已经成为靶向治疗药物中上市药物数量最多的靶点。
国内企业均瞄准成熟适应症
跨国药企在国内上市的2个PD-1单抗和2个PD-L1单抗的首次上市适应症均不相同,但是国内企业药物的首次上市适应症同质化较为严重,稳妥起见都选择了临床成熟的适应症。
在6个国产PD-1单抗中,有5个首次上市适应症均为后线治疗霍奇金淋巴瘤,且都是附条件批准,只有特瑞普利单抗的上市切入点是二线治疗晚期黑色素瘤。
连续下降的药品价格打击原本市场想象空间
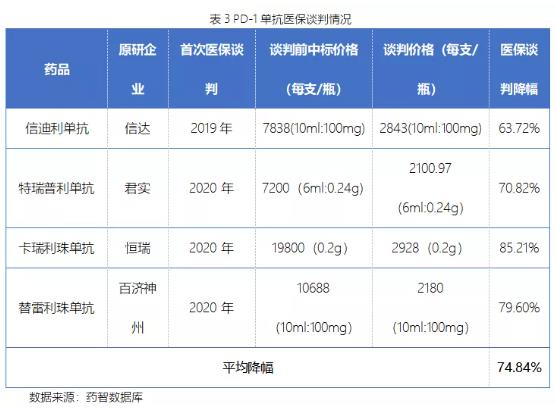
目前国内已上市的11款药物中只有4个成功通过谈判纳入医保,平均价格降幅达到74.84%。并且随着这四个药物适应症不断扩张,续约谈判时很有可能价格会继续大幅度下杀。
现在的主流形势是国产药物上市后会快速通过谈判进入医保,这样的话今年在医保谈判前上市的派安普利单抗和赛帕利单抗就都会进入医保,导致进口药物也有可能会因此承受不住销售压力而也在此次谈判中接受医保局的价格,毕竟在这之前进口药物在国内已经开始自主降价。
在这个为了提高患者依从性而进行的内卷式竞争环境里,药品的未来市场想象空间与上市前相比肯定会巨幅下降,进而导致药企的高估值也难以维持,资本市场寒潮将至。
围城外的依旧虎视眈眈
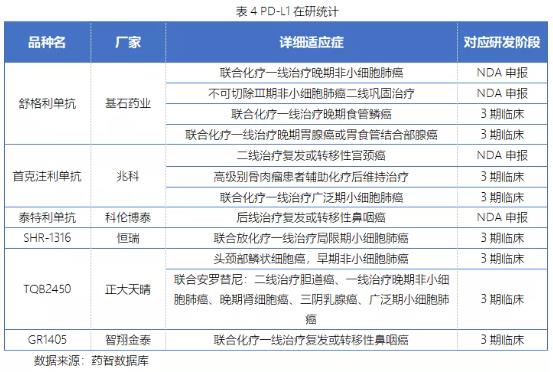
在上市药品竞争白热化的情况下,依旧有大量品种在围城外加速研发争取早日上市。在这里面跑得比较快的已经到NDA或3期临床阶段,一共有6个品种有望在近几年上市,其中有3个已经进行NDA申报。
但是抛开有效性及安全性数据不谈,这些品种的适应症大多数都是已有上市PD-(L)1单抗,如非小细胞肺癌的一线治疗和鼻咽癌的后线治疗等。随着CDE在审评环节的逐步收紧,临床成熟适应症作为上市切入点已经开始变得越来越难。
差异化研发才是NDA成功率的保障
2021年11月3日,信达以3期化疗对照实验进行信迪利单抗的新适应症申报未得到CDE的批准。这是首个未被批准的PD-(L)1新药申请,这是明显的CDE对该类药物审评收紧的信号,标志着PD-(L)1药物研发野蛮生长的时代即将结束。
针对这一情况资本市场早已做出应对,各个药企难以维持的高市盈率以及股价的腰斩和新股的破发无不标志着最强医药资本寒潮的到来。
同时在政策上也开始做出应对,CDE今年连续发布《中国新药注册临床试验现状年度报告(2020年)》与《以临床价值为导向的抗肿瘤药物临床研发指导原则》,直指未来新药应以临床价值为第一目标,对Me Too类药物未来应该提高审评审批标准,引导新药产业有序合理发展。

