“14:1”信达碰壁!国产PD-1“出海”须补做临床!中国创新遇阻?信达礼来回应来了
历史总是惊人的相似。
三年前,君实生物的特瑞普利单抗获批上市,抢去了信达生物信迪利单抗“首个国产PD-1”光环。彼时,信迪利单抗因数据不充分主动撤回申报,成为了俞德超心中颇为尴尬的回忆。
2018年春节前夕,在北京市海淀区复兴路中国科技会堂,国家药监局药审中心(CDE)组织召开了“抗PD-1/PD-L1单抗申报资料要求专题研讨会”,会议现场,“是否接受单臂试验”“有条件批准”“替代终点”“临床核查”“生产现场检查”等话题,让每一位在场的企业人员无比紧张。
如果不是因为参会人员有限制,这个并不宽敞的会议室,椅子都不够坐。时任信达生物临床开发高级医学总监的周辉,在现场就IBI308(信迪利单抗)的基本情况和临床开发过程做了介绍。然而,这些信息并没有能够打消CDE的监管疑虑。彼时,CDE决定:由于信迪利单抗数据不充分,将不予召开注册沟通会。一个月后,原本在国内PD-1/L1单抗研发竞速中领先的信达生物,低调撤回了信迪利单抗的上市申请。

4年前的“抗PD-1/PD-L1单抗申报资料要求专题研讨会”现场
时光匆匆,2022年春节刚过,“信迪利单抗迎来美国FDA大考”的消息,成为了壬寅虎年正月最受医药市场关注的热门话题。
无论是对于“吃瓜”的资本市场玩家,还是行医药产业资深人士,中国大分子抗体药物能否取得“零的突破”无疑极具关注度。(点击回顾→倒计时5天!信达迎大考!中国PD-1/L1“出海”寻机?)
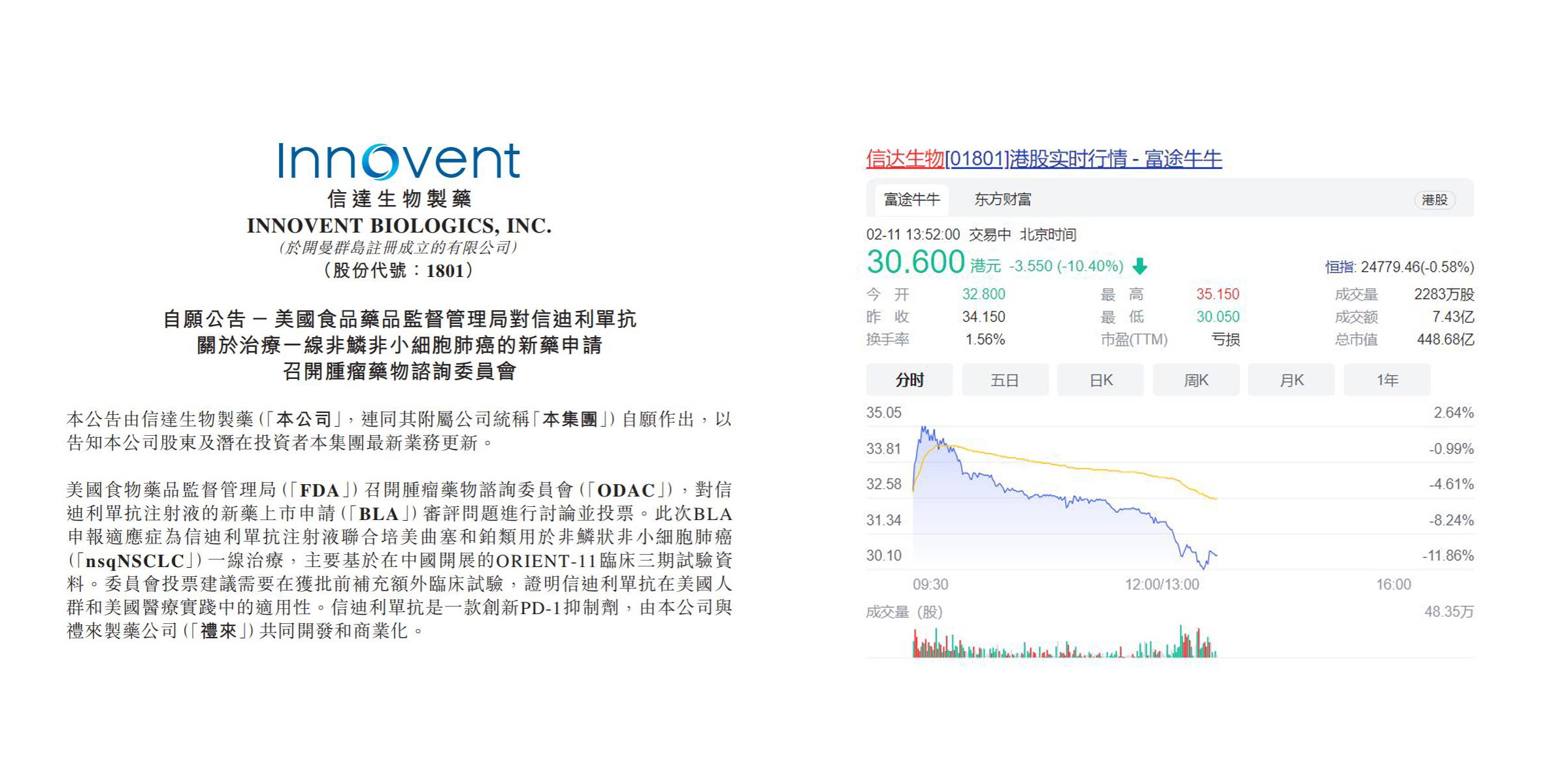
然而,就在今天凌晨刚刚结束的美国FDA肿瘤药物咨询委员会(ODAC)会议上,经过5个小时的讨论,委员会专家以14:1的投票结果,认定信迪利单抗仅凭借ORIENT-11临床研究不足以获得监管批准,需要补充临床试验。
这无疑给众多熬夜守候在大洋彼岸的中国医药人,上了生动的一课。
线上直播

投票结果:14-1,要求补做临床试验,直接获批绝无可能!
经此一役,信达生物信迪利单抗的美国BLA审批,正如早前国内申报一样,产品在海外的上市时间将进一步推迟,大分子药物“零的突破”花落谁家仍保留着悬念。此外,美国FDA“杀鸡儆猴”,会让众多行走在“出海”之路的中国PD-1/L1抗体新药,乃至大分子药物,面对怎样的国际化形势?
论战——FDA:ORIENT-11没接受美国监管!
早在两天前,美国FDA官方网站就已经公布了ODAC讨论的相关信息,其中包括ODAC委员名单(Committee Roster)、参会人员名单(Meeting Roster)、会议日程、讨论议题,以及会议全过程美国FDA与信达生物/礼来的信迪利单抗相关资料。

会议日程
值得关注的是,ODAC现场主要讨论两个话题,并设有一个投票环节:
讨论话题1:ORIENT-11(信达在中国进行的关键Ⅲ期临床试验)对美国人群和美国医疗实践的普遍适用性(generalizability)。
讨论话题2:对美国人群而言,解决ORIENT-11的普遍适用性问题的潜在临床试验是什么样的。
投票:鉴于ORIENT-11可能不适用于美国患者或美国医疗实践,在批准之前是否还需要进行其他的临床试验?
根据会议日程名单,信达生物方面安排的全球注册负责人Lana Shiu和美国公司总裁Eduard Gasal,都是2021年加入公司海外团队的高管。显然,为了信迪利单抗和下一步的国际化,信达生物做了比较充分的准备。
在信达生物和礼来的介绍中,气氛颇为平和。
据悉,信迪利单抗于2021年3月向美国FDA提交BLA之前,已经与FDA进行了多次监管沟通。在这些会议上,包括安全性分析、免疫相关不良事件(irAE)、电子数据集、无进展生存期(PFS)和总生存期(OS)等数据信息,均需要向FDA进行提交;鉴于 ORIENT-11仅在中国进行,因此申请人还被要求提交“包括讨论研究人群如何在疾病特征、性别、种族、年龄和标准治疗方面充分代表美国患者人群。”
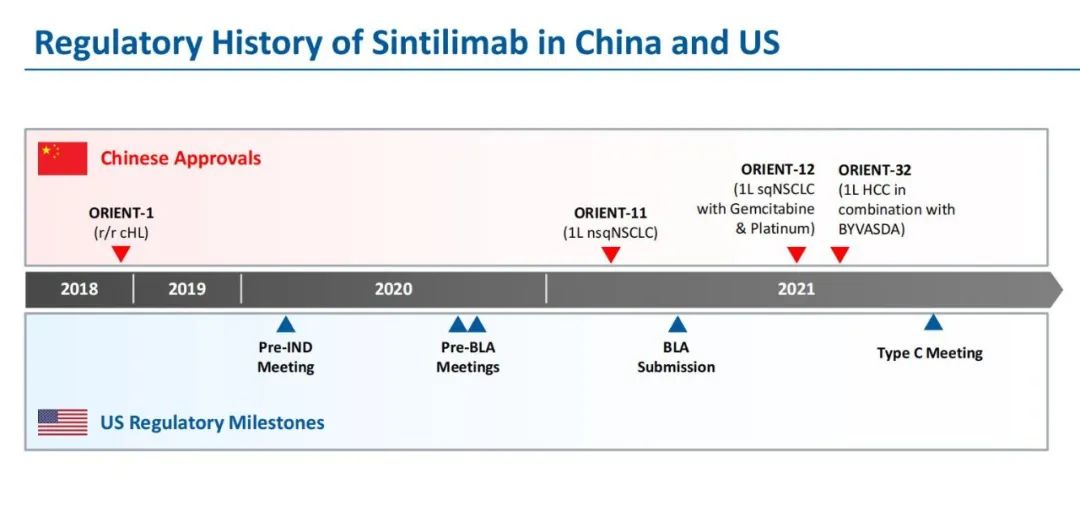
信达生物/礼来整理的“时间轴”
不过,美国FDA的口径则有所不同,以至于监管官员在会议现场直接做出“澄清”,认为信达生物/礼来方面颇有“先斩后奏”之嫌。
仅针对ORIENT-11这一临床试验,FDA表示信达生物和礼来并没有正式在美国申请过IND,没有在美国进行试验,实际上没有接受过FDA监管,而是于2018年8月直接启动临床试验,且未告知FDA,直到获得了初步数据显示具有统计学意义的PFS改善,才于2020年4月与FDA沟通。同时,美国FDA在开Pre-BLA 会议时提醒信达生物和礼来方面,进一步完善数据才能够获得监管认可。
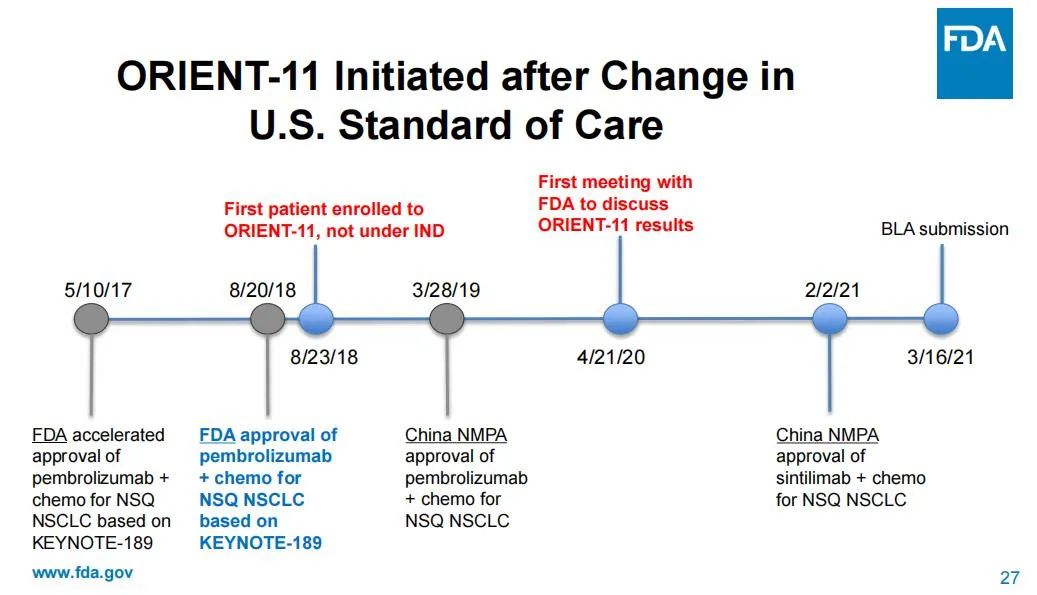
美国FDA整理的“时间轴”
事实上,2018年,美国FDA基于KEYNOTE-189研究的阳性结果正式批准帕博利珠单抗(Keytruda)联合含铂化疗一线治疗非鳞非小细胞肺癌,这直接导致了ORIENT-11的临床试验方案与美国临床实践存在差异。因为美国的临床医生在2018年Keytruda获批适应症之后,一线治疗就会选择免疫治疗而非单纯化疗,并且免疫治疗已经可以得到OS获益。然而,这一适应症是2019年在中国获批,此后改变了中国的临床实践。
同时,基于Keytruda在非小细胞肺癌领域缔造的一线治疗标准,后续的一系列获得美国FDA批准的非小细胞肺癌免疫治疗方案,诸如Tecentriq联合化疗、Opdivo和Yervoy“双免疗法”、Libtayo单药等,均包含OS数据,细分领域的临床需求已经基本得到满足;而ORIENT-11仅有PFS数据。
此外,美国FDA还列举了非鳞非小细胞肺癌在美国人群、KEYNOTE-189研究与ORIENT-11研究方面的群体差异,在人种、性别、年龄、吸烟者比例等多个维度,ORIENT-11都难以契合美国人群的临床需求。
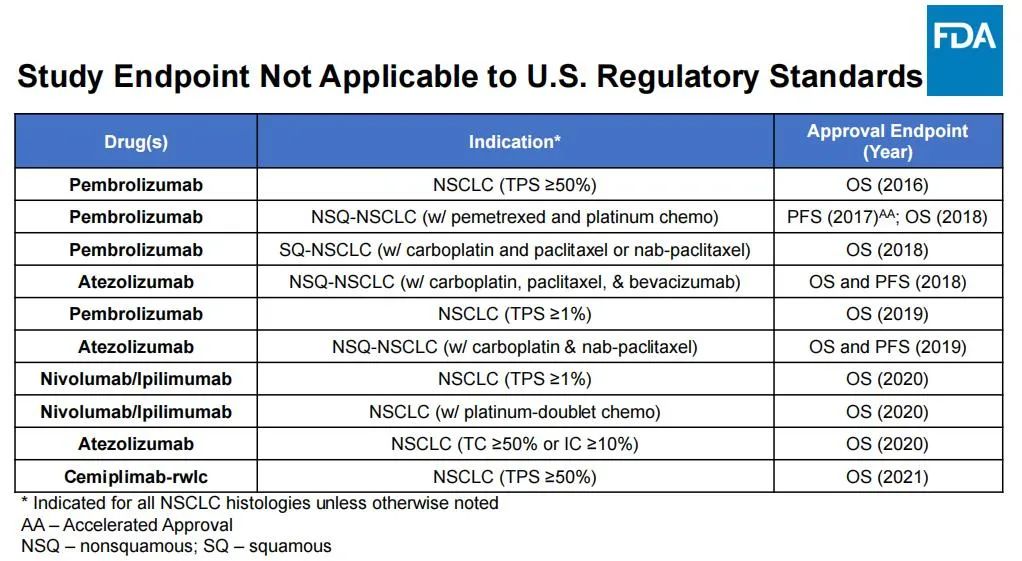
美国FDA批准非小细胞肺癌适应症情况
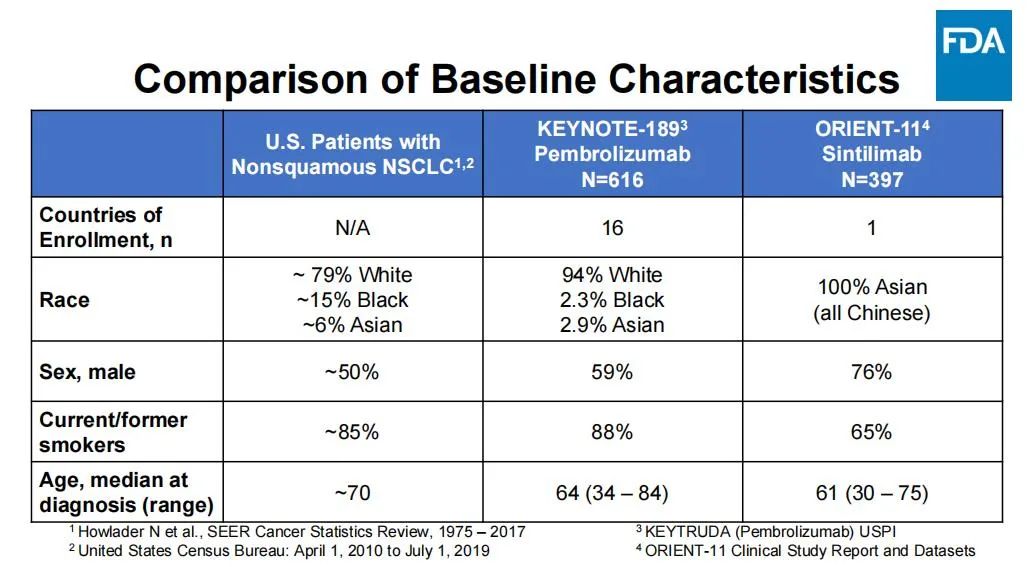
ORIENT-11研究的“特殊性”
纵然,现场信达生物和礼来的企业代表使出浑身解数,充分强调非鳞非小细胞肺癌在美国的患者和临床治疗情况,以及ORIENT-11数据结果和信迪利单抗中国获批给肿瘤免疫治疗药物可及性带来的改善,并且进一步针对补充Meta分析侧面印证信迪利单抗和已经获批在美国应用的同类产品在安全性和有效性方面保持一致,但是,美国FDA坚持强调BLA审评是基于特定的临床试验数据,而绝非事后分析。
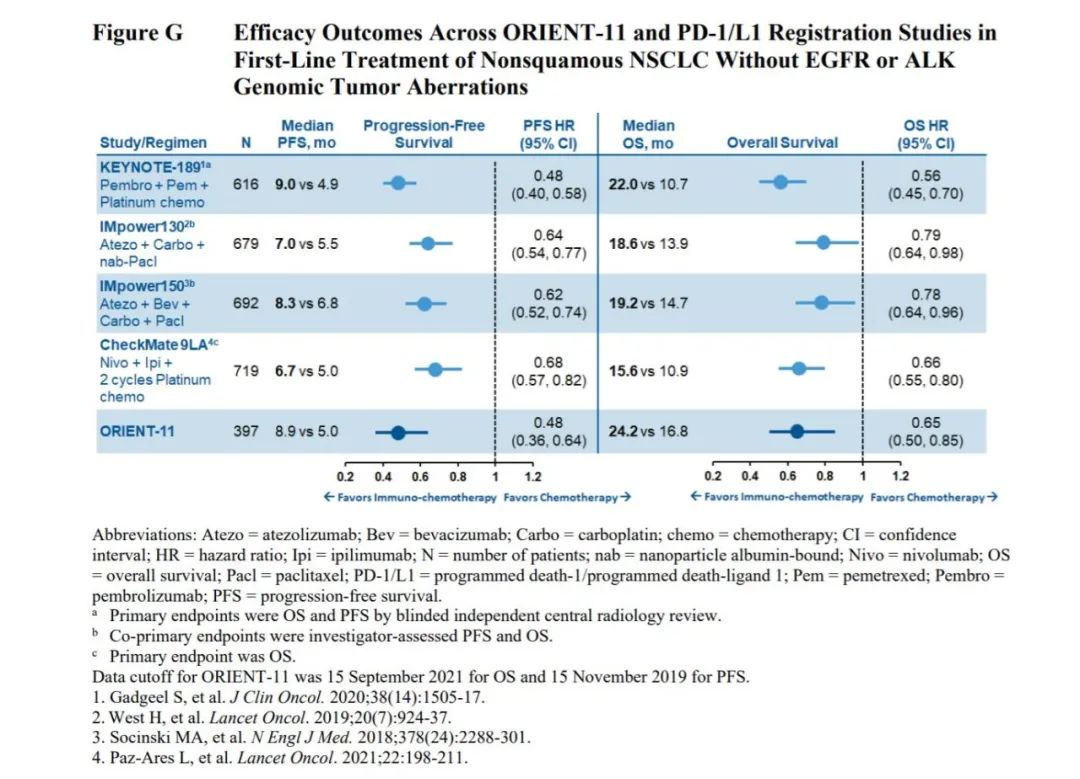
信达生物和礼来提交的补充Meta分析
从两个讨论话题和一个投票,已经不难预判美国FDA的监管态度:
仅凭ORIENT-11的中国临床研究数据,无法获得信迪利单抗的上市批准!
最终的投票结果也将ODAC委员专家与FDA监管官员拉到了统一战线,并对信达生物/礼来在ICH规则、伦理、审评流程等方面存在的问题,给予“完善”和“改进”的要求。
这意味着,信达生物在美国临床需求基本得到满足的非小细胞肺癌领域,必须开展新的临床试验,以进一步严谨、全面地向FDA提交数据,OS终点、“头对头”成为信迪利单抗必须面对的艰巨挑战。
震惊——参照生物类似药定价?
就在ODAC讨论如火如荼的时候,海外媒体援引礼来公司发言人的观点,称礼来一直致力于为信迪利单抗未来拟定“颠覆性”的定价策略:如果这款药物能够获得FDA批准,与目前已经获批上市的PD-1药物价格相比,礼来计划为药物的批发采购成本提供大约40%的折扣。
目前,Keytruda已经成长为“超级重磅炸弹”。据默沙东最新发布的年报,2021年Keytruda销售额再度刷新纪录,达到了171.86亿美元,同比增长20%。巨大的美国市场,显然值得做一场监管博弈。
一方面,“让老百姓用得起生物药”不只针对中国人,美国创新药的临床需求仍有待进一步满足,而“用得起创新药”显然也是一种需要满足的需求,这不仅可以为患者省钱,也可能为美国医保系统节省数十亿美元资金。
另一方面,无论现阶段美国FDA对于信迪利单抗的监管结果如何,非小细胞肺癌作为大癌种,也仅仅是产品申报的一个适应症,面对更多的适应症,用“价格”给监管制造药物可及性和可负担性的舆论压力,正是企业所求。
不过,美国FDA明确ODAC讨论的议题并不包括价格相关话题,因为FDA对于药品价格并没有监管权利。“当人们买不起药时,药物的成本就是一种未得到满足的医疗需求。”这或许是个伪命题。
此外,对于降价是否直接等于竞争力,市场也有自己的观点。部分行业分析师认为,低价格有可能导致“反竞争”的效果,事实上部分价格更高的市场主导药物可以通过向大处方者提供更高的返点来构筑竞争壁垒,这导致部分机构甚至有可能更喜欢价格更高的药物;另一部分行业人士则认为,对于部分支付方,一些小的区域市场,有可能会倾向低价格药物。

不过,无论谁买单,令人震惊的是,礼来对于信迪利单抗的海外定价是参考生物类似药。
在海外媒体的报道中,礼来方面表示:“40%的折扣与生物类似药相对于原研生物药的折扣基本一致,而生物类似药被证实可以扰乱原研生物药的市场格局,Avastin(贝伐珠单抗)、Rituxan(利妥昔单抗)和Herceptin(曲妥珠单抗)由于受到生物类似药的影响,销售额均大幅下滑,已经可以说明问题。”
市场人士分析认为,想要以创新药的身份获得BLA批准,就需要“头对头”,巨大的研发成本是挑战。而在产品上市之后,却只能以生物类似药的形象和价格进行竞争,这种市场尴尬恐怕是本土医药创新企业始料未及的结果。
压力——“要给中国公司‘定规矩’!”
搅动市场格局不是美国FDA在意的关键,药品监管始终关注的是临床需求,聚焦的是药物的临床价值,核心是围绕安全性、有效性的科学视角。
正如ODAC专家学者在本次会议上所言:“重点不在于信迪利单抗本身的审批结果,关键在于给后面排队的数十家申请人‘定规矩’!”
美国FDA在这个特殊的审评节点,运用召开ODAC会议的形式,正是力图传递一个信号:创新药不必然是全新的,但它一定要满足临床需求。
然而,对于很多中国的医药创新企业而言,却只看了前半句。
参照ICH E5和E17的指导原则,美国FDA一针见血指出ORIENT-11并不是MRCT,此外ORIENT-11整体研究并未能和E17中的指导原则保持一致。言外之意,ORIENT-11研究所呈现的“阳性”结果并不适用于美国,无法满足美国的临床需求。
此外,美国FDA此前已经明确了基于国外数据的药物,特别是针对药物可及性无法满足的患者群体的新疗法药物的相关要求。本次会议,专家委员普遍表示,信迪利单抗不具有“监管灵活性”,主要因为其有多种类似药物可供使用,且患者的生存数据更成熟。
遵循21 CFR 314.106 中概述的监管法规,能够基于国外数据进行审批,享受“监管灵活性”,必须具备三个条件:1.具备未被满足的临床需求;2.罕见病,难以开展MRCT研究;3.原创新药。

由于中国大量的创新药实际上是me-too,这就与“novel drug class”存在很大的距离。想要获得美国FDA的“监管灵活性”,必须从未被满足的临床需求和罕见病方面入手。
业内专家在采访中表示,中国对于me-too药物已经走向了两个极端,一个极端认为me-too没有创新价值,另一个极端认为me-too是短平快的“创新”。“无论是first-in-class,还是me-too,亦或是仿制药,满足未被满足的临床需求,体现药物的临床价值,才是创新的核心。K药是O药的me-too,但正是凭借持续地创新,不断满足临床需求,让它超过O药成为了me-better!”
Me-too没问题,没有创新的me-too才是大问题!当一大批中国me-too药物蜂拥而至,在美国已经基本得到满足的临床适应症赛道上,简单、机械重复着跨国药企已经做过的临床试验,扎堆相同的适应症却没有循证依据体现临床优势,这显然不是以临床价值为导向,而只会让美国FDA浪费审评资源。站在监管者的视角,这个逻辑似乎不难理解。
FDA 肿瘤学卓越中心主任 Richard Pazdur表示,之所以改变“口径”,强调收紧“监管灵活性”,主要原因在于,部分美国制药公司正在与中国合作伙伴利用规则将不具备临床价值的创新药物带到美国。“我们不是有一个或两个这样的药,我们已经为拟议的PD-1检查点抑制剂举行了25次会议,中国还有数十个在研品种。”
除了信达生物和礼来之外,诺华还与百济神州合作开发了后来的替雷利珠单抗,此前EQRx已经获得了基石药业的舒格利单抗独家使用权,Coherus Biosciences也已经与君实生物合作开发了特瑞普利单抗,其他公司也在大分子药物方面与众多中国公司达成了协议。
一想到后面还有众多中国PD-1/L1跑步入场,美国FDA也难免压力山大。
尾声——“出海”成本飙涨,中国创新道阻且长
从本次信达生物信迪利单抗的监管沟通过程,已经可以明确得出结论:对于在美国选择常规大适应症,上市获批药物众多的领域,“头对头”、“长期硬终点”、MRCT将成为标配!
行业普遍认为,这种监管趋势,必将直接推高中国医药创新企业的“出海”成本。
以此前成功实现小分子创新药海外上市“零的突破”的泽布替尼为例,仅购买对照药,一个受试者一年就需要10万美元,仅一项400位受试者的临床研究,成本就是“天文数字”。
相比之下,用Keytruda做“头对头”,对照药的成本投入只多不少,而且还需要直面阴性结果的风险。
这种担忧并非毫无根据,2021年,国内某上市公司自主研发的1类创新大分子药物,就宣告在国际多中心Ⅲ期临床试验中遭遇失败,这在某种程度上暴露了医药创新面对国际多中心临床试验从计划、设计、执行全过程中都可能存在风险。这势必劝退部分资金紧张、缺乏硬核创新实力的中国药企。

回归临床价值,聚焦临床需求,这才是中国药企创新“出海”的正确姿势。正如美国FDA在文件中提出的“unmet need”关键词,绝对不容忽视。这意味着,要么高举高打直接向头部重磅发起挑战,要么积极寻求差异化,寻找亚洲人群独有同时欧美人群罕见或忽视的适应症。
无论是药物研发还是药品监管,始终都是一门科学,容不得“抄近路”!
资本市场对此反应强烈。信达生物和礼来双方均在美国FDA ODAC讨论结果发布之后,第一时间发布回应公告,表示ORIENT-11是一项高质量、高标准、由经验丰富的临床研究者参与的符合全球认证GCP要求的中国临床试验,随着监管和市场形势的变化,委员会投票建议需要在获批前补充额外临床试验,证明信迪利单抗在美国人群和美国医疗实践中的适用性。然而,市场情绪已经开始发酵,信达生物的股价在开盘后短暂企稳随即大幅走低,截至发稿,跌幅已经超过10%。