直击 2022AACR!全球重磅研究都有啥?
近日,2022AACR年会大幕拉开。作为全球规模最大的癌症研究会议之一,AACR汇聚了来自世界各地的肿瘤学研究与临床进展。免疫时间梳理了部分重磅研究与国产创新药的最新进展,看看有哪些先锋企业独领风骚?
K药押注黑色素瘤,NSCLC竞争激烈
CT014
这是针对PD-1免疫治疗耐药的黑色素瘤患者瘤内注射BO-112联合系统性帕博利珠单抗(Keytruda)治疗的效果评价:II期SPOTLIGHT 203临床试验最终结果。
该研究是针对黑色素瘤(皮肤、肢端或黏膜)患者以及接受抗PD-1治疗仍然疾病进展患者进行瘤内注射BO-112和静脉应用帕博利珠单抗(Keytruda)的单臂临床研究(NCT04570332)。2021年4月24日完成了42例患者招募入组,女性占43%,中位年龄66岁(27~88岁)。
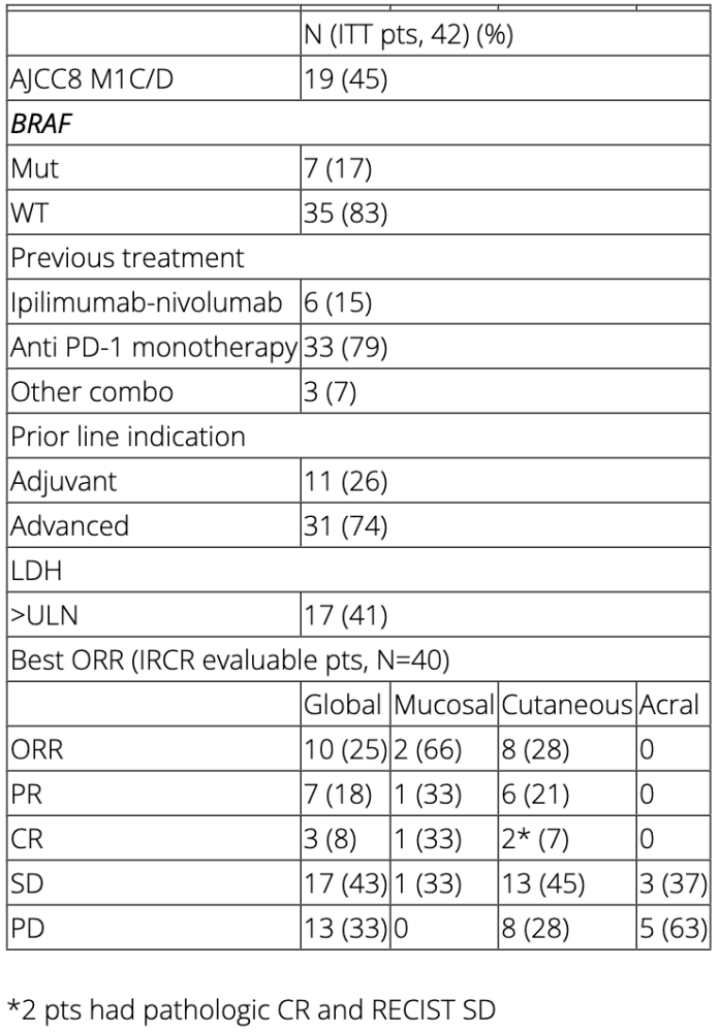
对40例患者进行治疗反应评估,其中10例(25%)患者治疗响应:3例患者完全缓解,7例患者部分缓解。17例(44%)患者处于疾病稳定期,同时疾病控制率达68%(18例患者仍在接受治疗)。该研究已达主要疗效终点,对此类无法应用标准治疗的黑色素瘤患者,该方案可达到持久、有临床意义的疾病控制。
CT538
在INSIGHT试验的主要分析中(NCT01982955;中位随访:21.8个月),特泊替尼+吉非替尼对EGFR突变的NSCLC和因MET扩增而对抗EGFR治疗产生耐药性的患者的疗效比化疗(CTX)有所提高。
结果显示,在19/55名随机患者中(34.5%)有MET扩增(GCN≥5,n=18;MET:CEP7≥2,n=13;METIHC3+,n=17),中位年龄为60.4岁,68.4%从不吸烟,之前使用的EGFR抑制剂为吉非替尼(57.9%)、阿法替尼(21.1%)、厄洛替尼(10.5%)和艾可替尼(10.5%)。特泊替尼+吉非替尼的中位治疗时间为11.3个月(范围:1.1-56.5),6名患者(31.6%)的治疗时间超过1年,3名患者(15.8%)超过4年。
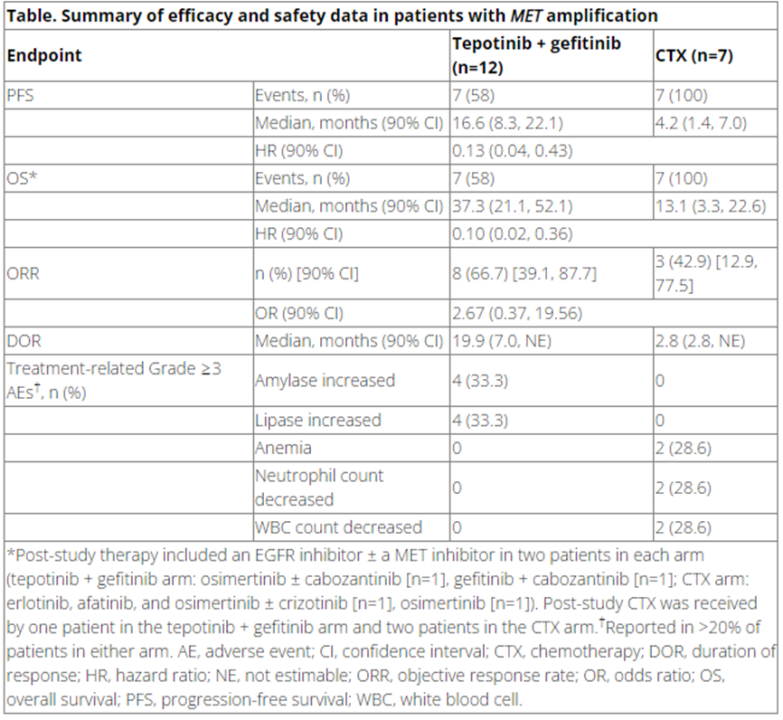
总的来说,与CTX相比,特泊替尼+吉非替尼改善了PFS(HR=0.13;95%CI:0.04,0.43)、总生存期(HR=0.10;95%CI0.02,0.36)、客观反应率和反应持续时间。与治疗相关的≥3级副作用发生在7名患者(58.3%)使用特泊提尼+吉非替尼,5名(71.4%)使用CTX。在METIHC3+的患者中(n=34;包括17名MET扩增的患者),与CTX相比,特泊提尼+吉非替尼也明显改善了PFS(HR=0.35;95%CI0.17,0.74)和OS(HR=0.44;95%CI0.23,0.84)。在有MET扩增的EGFR突变型NSCLC患者中,特泊替尼+吉非替尼大大改善了PFS和OS。
CT034
谷美替尼(Glumetinib,SCC244)是一种高选择性、有效的口服c-MET抑制剂。上海市胸科医院陆舜团队首次汇报了SCC244在METex14突变的NSCLC患者中进行的单臂、II临床试验(GLORY试验)的试验结果。GLORY试验是一项开放性、国际性、多中心、单臂II期临床试验,旨在评估SCC244治疗局部晚期或转移性NSCLC患者的有效性和安全性,这些患者均携带METex14突变(中心实验室确认),并且一线或二线药物系统治疗后失败,或者在充分评估后不符合或者拒绝接受化疗。
截至2021年5月6日,从来自42个地区的163位患者中筛选出73例,在300毫克QD剂量下进行治疗。其中69例经中心实验室确认为METex14突变。在69名患者中,经BIRC评估,总体ORR为60.9%(95%CI:48.4%-72.4%)未接受过治疗的患者和之前接受过治疗的患者的ORR分别为66.7%(95%CI:50.5-80.4)和51.9%(95%CI:31.9-71.3)。中位DoR为8.2个月(95%CI:4.8,NE),中位PFS为7.6个月(95%CI:4.2,NE),42名应答者中有30人的肿瘤反应仍在进行。反应发生得很快,中位TTR为1.4个月(范围:1.2,4.2)。10名有脑转移的患者中,有8名观察到部分反应。5名被选为靶向病灶的脑转移患者在INV下有颅内反应,颅内肿瘤缩小的中位数为57%(范围:34%,71%)。
综上数据显示,SCC244对具有METex14突变的NSCLC患者在不同的治疗线中具有较高和强大的疗效,并具有明显的颅内抗肿瘤活性。这些数据支持SCC244作为METex14 NSCLC患者的一种有价值的靶向治疗选择。
CT555
在KEYNOTE-042这项全球Ⅲ期临床研究中,相比于化疗,帕博利珠单抗治疗可显著延长未经治疗的晚期/转移性NSCLC患者(PD-L1TPS【肿瘤比例评分】≥1%,无EGFR/ALK突变)的总生存期。对于研究中的中国患者,相比于化疗,帕博利珠单抗治疗在PD-L1TPS≥50%(HR0.63,95CI%0.43-0.94)、TPS≥20%(HR0.66,95CI%0.47-0.92)、TPS≥1%(HR0.67,95CI%0.50-0.89)的患者中,均可延长总生存期。
广东省人民医院吴一龙团队对Keynote-042研究中的中国患者继续随访了14个月,在本次AACR会议中报告了最新的患者疗效和安全性结果。研究共纳入了262例PD-L1 TPS≥1%的患者,其中帕博利珠单抗治疗组(pembro组)128例,化疗组(chemo组)134例。患者从入组到数据截止收集(2021年4月28日)的中位时间为47.2个月(39.8-56.1月)。
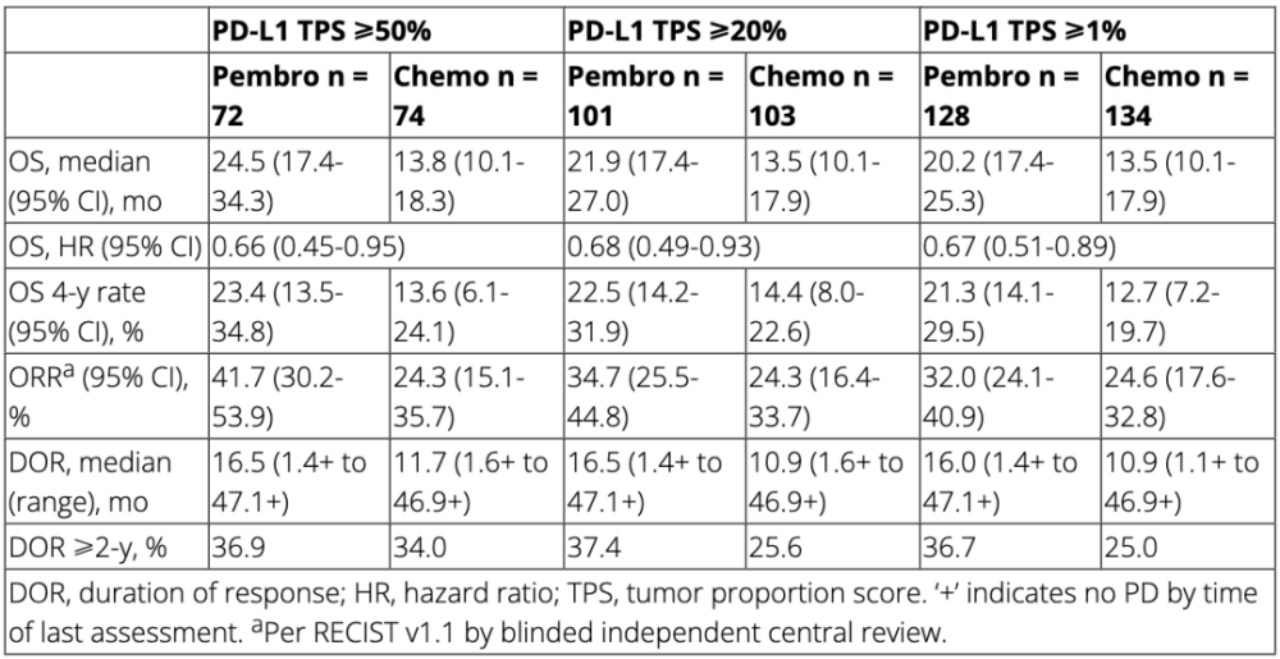
与化疗相比,在PD-L1 TPS≥50%(HR0.66,95CI%0.45-0.95)、≥20%(HR0.68,95CI%0.49-0.93)和≥1%(HR0.67,95CI%0.51-0.89)的患者中,帕博利珠单抗治疗可延长了患者总生存期。pembro组和chemo组分别有19.5%和68.8%的患者出现与治疗相关的3-5级不良反应。在完成35个周期帕博利珠单抗治疗的22例患者中,总有效率为81.8%(95%CI59.7%-94.8%),随机化后4年的估计生存率为69.1%(详细数据见上表)。在数据收集截止时,每组中有79例患者开始了后续治疗,其中有4例患者开始了第二个疗程的帕博利珠单抗治疗。
本研究显示,与Keynote-042研究结果类似,在中国晚期/转移性PD-L1阳性NSCLC患者(无EGFR/ALK突变)中,通过近4年的随访,帕博利珠单抗作为一线治疗可延长患者生存期,并产生持久的治疗作用,帕博利珠单抗单药治疗可成为此类型患者的标准治疗方式。
信达、复星亮相AACR,恒瑞、贝达创新成果大放异彩
除上述产品之外,随着中国生物医药领域创新活力迸发,更多的国产创新药也开始在国际舞台上崭露头角。
恒瑞医药:PD-L1单抗adebrelimab一线治疗ES-SCLC临床III期成功
SHR-1316(Adebrelimab)是恒瑞自主研发的人源化抗PD-L1单克隆抗体,能通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。恒瑞医药在2022AACR年会上公布了PD-L1单抗adebrelimab(SHR-1316)联合标准化疗用于一线治疗ES-SCLC的临床III期试验数据。
该双盲临床III期试验中入组了未接受过系统性治疗的ES-SCLC患者,按1:1随机分配接受4-6个周期的adebrelimab(20mg/kg,静脉注射,d1,q3w)或安慰剂,并联合卡铂(AUC5,d1,q3w)+依托泊苷(100mg/m2,d1,d2,d3,q3w),随后接受adebrelimab或安慰剂的维持治疗。主要终点是OS。
疗效结果:入组的462名患者被随机分组并接受adebrelimab+化疗(n=230)或安慰剂+化疗(n=232)治疗。截至2021年10月8日,所有患者的中位随访时间为13.5个月(存活患者为22.5个月)。adebrelimab+化疗组相比或安慰剂+化疗组OS显著延长;12个月OS率分别为62.9%和52.0%,24个月OS率分别为31.3%和17.2%。经独立审查委员会(IRC)确认的PFS分别为5.8个月和5.6个月;6个月PFS率为49.4%和37.3%,12个月PFS率为19.7%和5.9%。ORR分别为70.4%和65.9%,中位DoR分别为5.6个月和4.6个月。表现出相比安慰剂+化疗更优的治疗效果。
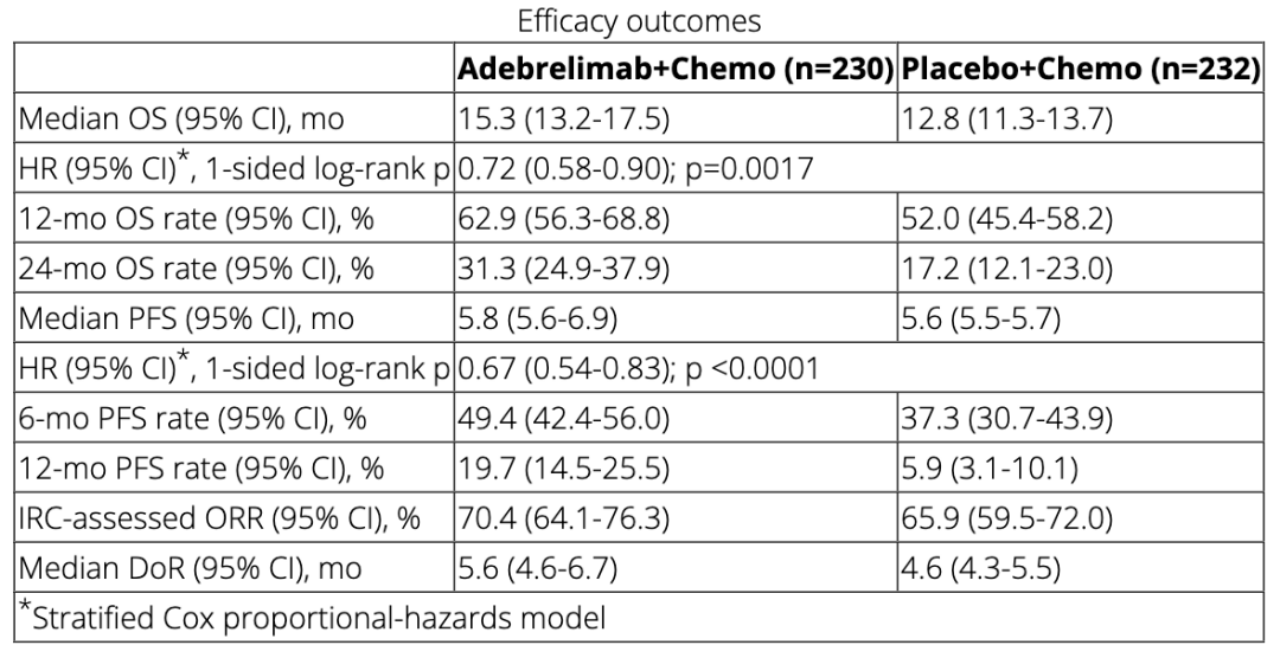
安全性结果:adebrelimab+化疗和安慰剂+化疗组中分别有85.7%和84.9%的患者发生≥3级TRAE,两组中最常见(≥5%)的TRAE均为血液学毒性。
信达生物:IBI322单药治疗晚期实体瘤First-in-human临床试验结果
IBI322是信达生物研发的抗CD47/PD-L1双特异性抗体,可同时阻断PD-1/PD-L1和CD47/SIRP-α通路。IBI322采用了对CD47结合亲和力较低和对PD-L1结合亲和力较高的“不平衡”设计,临床前试验显示出比传统CD47单抗对CD47+/PD-L1+肿瘤CD47更强的选择性阻断。
信达在2022AACR年会上公布了IBI322单药用于治疗晚期实体瘤患者的的first-in-human临床I期研究早期剂量递增/扩展部分的结果。该临床I期试验招募了18-75岁,ECOGPS0-1的患有局部晚期、复发性或转移性实体瘤患者。剂量递增部分采用加速滴定和标准3+3设计,静脉注射0.01-45mg/kg,每周一次、两次或三次。剂量扩展部分采取10-30mg/kg,每周2-3次的给药剂量。截至2021年10月12日,共招募了58名患者,年龄53±11.7岁,其中37名男性(63.8%),ECOGPS1的患者38名(65.5%),曾接受过ICI治疗的患者15名(25.9%)。
疗效结果:在接受有效剂量(≥10mg/kg)治疗并至少进行一次肿瘤评估的20名患者中,4名(20%)达到PR,7名(35%)达到SD。在接受有效剂量(≥10mg/kg)治疗的9名NSCLC患者(包括4名先前ICI治疗失败的患者)中,3名(33.3%)达到PR,5名(55.6%)达到SD。
安全性结果:仅有一例4级可逆性血小板减少症DLT发生在20mg/kgQ2W组。43名(74.1%)患者发生了各级别的TRAE。最常见的TRAE包括贫血(31.0%)、血小板减少(22.4%)和发热(15.5%)。13名(22.4%)患者发生≥3级TRAE,最常见的≥3级TRAE为血小板减少症(12.1%)。所有血小板减少症均无症状、短暂且在10天内可恢复,没有导致出血。10名(17.2%)患者发生了经研究者确认的免疫相关不良事件。两名(3.4%)患者出现输液反应。
复星医药:MEK1/2抑制剂FCN-159治疗NARS突变晚期黑色素瘤
MEK属于Ras/Raf/MEK/ERK通路,是双重特异性激酶,能够通过酪氨酸和苏氨酸2个调节位点的磷酸化激活下游的ERK,是Ras或Raf突变导致的恶性肿瘤的治疗靶点之一。FCN-159是复星医药研发的选择性MEK1/2抑制剂,复星在2022AACR年会上首次公布了其临床Ia期试验结果。这项在中国开展的单臂、开放标签、剂量递增的临床Ia期研究入组了携带NRAS突变的不可切除的III/IV期黑色素瘤患者,给药剂量从0.2mg直至MTD。截至2021年9月16日,共入组33名患者接受0.2-15mg剂量的FCN-159。
疗效结果:在接受FCN-159剂量≥6mg的21名患者中,ORR为19.0%(n=4),均为PR。中位DOR为4.8个月。7名患者达到SD(CBR,52.4%)。中位PFS为3.8个月。根据安全性、抗肿瘤活性和药代动力学数据的评估,确定RP2D为12mgQD。
安全性结果:15mg组发生1例DLT事件(3级毛囊炎),其他剂量水平未发生DLT;MTD定义为15mgQD。各剂量组中5名(15.2%)患者发生3级以上的TEAE,最常见的是口腔炎(6.1%,2名)。未发生严重的或导致治疗中断TEAE。
贝达药业:恩沙替尼治疗METex14突变NSCLC ORR达71%
恩沙替尼是贝达药业开发的中国第一个治疗ALK突变非小细胞肺癌的创新药。临床前研究显示:恩沙替尼能够有效结合c-MET,高效抑制MET外显子14缺失蛋白的激酶活性(IC50=7.9nM),并能够有效抑制MET通路以及小鼠皮下植入Hs746T细胞的生长。恩沙替尼的适应症有望进一步扩展,在2022AACR上,贝达首次公布了恩沙替尼治疗METex14突变的NSCLC的初步疗效数据。
疗效结果:共入组17名METex14突变的NSCLC患者,接受了225mgqd的恩沙替尼治疗。17名患者中1名(6%)达到CR,11名(65%)达到PR,4名(24%)达到SD。ORR为71%,DCR为94%。在MET-TKI初治患者中ORR高达到80%(12/15)。在2名脑转移患者中,1名患者达到脑部PR,另一名患者的脑部病变稳定了6个月。
安全性结果:最常报告的不良事件是皮疹、外周水肿和恶心,未发生致命的不良事件。

