癌症“不可成药性”靶点开发的春天
近年来,包括抑制癌症驱动基因在内的靶向治疗药物开发,极大地改善了多种不同癌症类型患者的预后。然而,数据显示,在研究已确定的大约700个癌症基因中,目前只有大约40个用于开发成的药物获得监管机构的批准。大多数制药公司和学术研究人员主要关注这些基因中的大约12个(表1)。
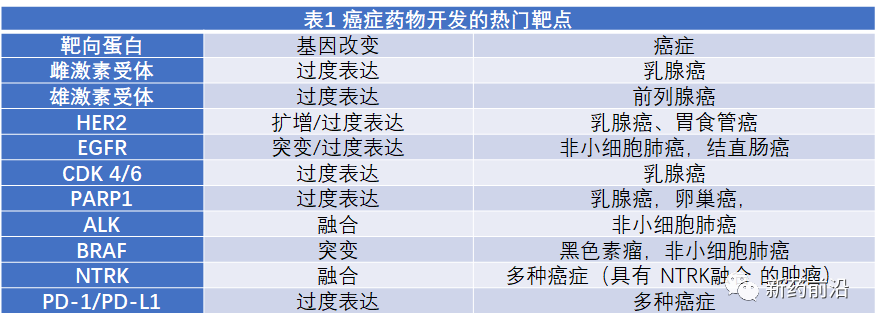
事实上,对于研究热门的几个基因中,已有多种靶向药物进入市场。例如,对于发病占15-20%的HER2基因扩增/过表达乳腺癌,至少有7种药物获得美国FDA批准,还有多种新药正在进行临床试验。同样,对于仅占3-5%的ALK重排非小细胞肺癌(NSCLC),也有5种药物获得FDA批准。与这些以少数驱动基因为靶点而开发了多种已上市药物相比,绝大多数的癌基因,包括一些最常被改变的基因,我们仍然缺乏经过临床验证的治疗方法。在人类癌症中,最常突变致癌基因RAS、最常见扩增基因MYC或最常突变抑癌基因TP53(p53)等最常改变的基因,由于这些基因编辑的蛋白产物已被证明难以靶向,因此传统上将它们称为“不可成药性”靶点。RAS、P53和MYC难以开发成为药物有3个原因:首先,这3种蛋白都缺乏一个易于识别的可接近的口袋(结合位点),以使潜在的低分子量药物可以高亲和力地与之结合。其次,除了RAS表现出弱的内在特性催化活性(GTPase),p53和MYC都不具有酶活性,因此不能被低分子量催化抑制剂靶向作用。最后,这3种蛋白都位于细胞内,即RAS位于细胞膜内层,p53和MYC均位于细胞内。尽管存在重重困难,但随着近年研究的深入和技术突破,“不可成药性”靶点正在取得积极进展,甚至是划时代突破。
KRAS开启里程碑
2021年5月,FDA加速批准安进(Amgen)公司开发的Lumakras(sotorasib)上市,用于治疗肿瘤携带KRASG12C突变的非小细胞肺癌(NSCLC)患者。Lumakras的批准代表着针对KRAS靶点药物开发的重大里程碑。
RAS是癌症中最常见的突变癌基因,在所有癌症中约有30%发生突变。RAS基因家族由3个成员组成,编码4种蛋白质,KRAS4a、KRAS4b、NRAS和HRAS。在RAS的3种形式中,突变最常见于KRAS(85%),其次是NRAS(12%)和HRAS(3%)。在KRAS中,几乎只在密码子12、13和61发现突变,分别对应于甘氨酸12(G12)、甘氨酸13(G13)和谷氨酰胺61(Q61)。KRAS突变在胰腺导管癌(95%)、结直肠癌(40%)和非小细胞肺癌(30%)中最常见。靶向RAS的研究尝试已经进行了25年以上。尽管理论上,可能会发现药物可以附着在RAS中的GDP/GTP结合位点,但实际上由于这些核苷酸的结合极其紧密(皮摩尔亲和力和缓慢的关闭率)以及细胞内GTP的高浓度,不太可能开发出涉及该位点的竞争性核苷酸抑制剂。因此,针对RAS的一些尝试集中在间接策略。
1抑制膜附着靶向RAS的首批尝试之一集中在阻止其与细胞膜内层的结合,这一过程是RAS发挥功能所必需的,需要异戊二烯化。异戊二烯化由2种酶催化,称为法尼基转移酶(FT)和香叶基香叶基转移酶(GGT)。最初开发出的FT抑制剂(FTI)并在几项临床前研究中显示出活性。三种FTI(tipifarnib、lonafarnib和salirasib)在KRAS突变的NSCLC、结直肠癌(CRC)和胰腺癌患者中进展到III期临床试验,但被证明在很大程度上缺乏疗效。然而,Kura Oncology开发的tipifarnib已被美国FDA授予快速通道指定,用于治疗HRAS突变头颈部鳞状细胞患者癌、复发性或难治性血管免疫母细胞性T细胞淋巴瘤、滤泡性T细胞淋巴瘤和具有T滤泡辅助表型的淋巴结外周T细胞淋巴瘤的成年患者。
2抑制下游信号传导另一种广泛研究的抑制RAS驱动肿瘤的策略涉及靶向下游信号传导通路。RAS通过多种途径介导下游信号传导,包括RAF-MEK-ERK、PI3K-AKT和RALGDS途径。已经针对这些途径中的特定蛋白开发了几种不同的抑制剂,尤其是针对RAF-MEK-ERK(vemurafenib、trametinib、selumetinib)和PI3K-AKT(buparlisib、apelisib)中的蛋白。然而,这些抑制剂在迄今为止测试的RAS突变临床前模型中基本上是无效的。这种缺乏有效性似乎主要是由于代偿机制,当用作单一药物时,这些机制否定了其潜在抑制能力。抑制下游信号的进一步策略包括防止RAS与其效应信号蛋白相互作用。Onconova公司开发的苄基苯乙烯基砜类化合物rigosertib通过连接到RAS效应器(包括RAF、PI3K和RALGDS)的结合域来充当RAS模拟物。因此,rigosertib阻断了来自这些效应蛋白的下游信号。与其阻断RAS效应蛋白相互作用的能力一致,rigosertib已被证明可抑制突变RAS依赖性肿瘤的多个临床前模型的生长。rigosertib已完成或目前正在进行30多项不同的临床试验。
3直接靶向KRAS特定突变形式尽管最初认为RAS缺乏适合结合低分子量化合物的口袋,但最近发现了几种小分子,不可逆地连接到KRASG12C突变蛋白中先前未识别的调节口袋。由于这些化合物依赖于突变的半胱氨酸残基进行结合,因此它们对野生型RAS没有可检测到的影响。然而,它们阻止核苷酸交换并将RASG12C蛋白锁定为非活性的GDP结合状态,从而阻止RAS与RAF相互作用并阻止下游信号传导。安进的sotorasib可选择性且不可逆地抑制突变蛋白并将其锁定为非活性的GDP结合形式。该药于今年5月率先冲过终点线,获得FDA加速批准,用于治疗肿瘤携带KRASG12C突变的非小细胞肺癌(NSCLC)患者,目前处于遥遥领先的位置。作为安进的竞争对手,Mirati公司的adagrasib在获得FDA授予用于治疗既往接受过全身治疗的KRASG12C突变非小细胞肺癌突破性疗法认证后,计划于2021年第四季度在美国提交该适应的新药上市申请。此外,还有多种KRAS G12C抑制剂进入到临床开发阶段(表2)。
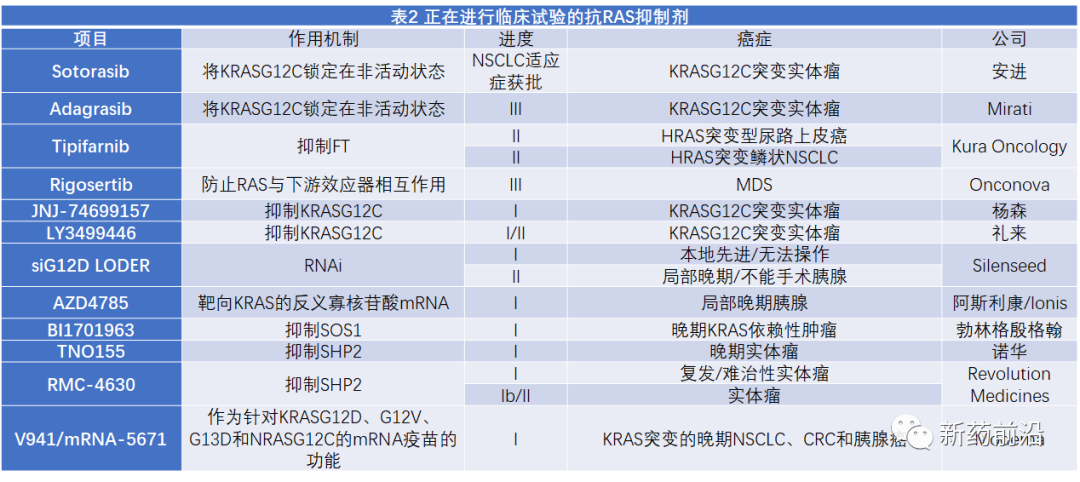
尽管KRASG12C抑制剂已取得突破,但应该指出的是,总体而言,KRASG12C突变在癌症中相对罕见(占KRAS突变的12%)。然而,该突变存在于13%的肺腺癌、3%的结直肠癌中,存在于大多数其他类型的肿瘤中不到2%。
p53:下一个突破
由TP53基因编码的蛋白p53,通常被称为“基因组的守护者”,其功能是防止癌症形成。因此,与RAS不同,p53是一种肿瘤抑制基因。尽管在40多年前就已发现,但p53阻止癌症形成的确切机制尚不清楚。最初,研究者认为抑制肿瘤发生是通过p53介导的蛋白诱导,参与细胞周期停滞、细胞凋亡或衰老。然而,最近发现诱导这些过程对于p53介导的小鼠自发性肿瘤发展的抑制是可有可无的,这表明可能还涉及其他途径。p53可以预防癌症形成的其他机制包括修复受损DNA、调节活性氧(ROS)形成、诱导铁死亡(一种铁依赖性细胞死亡形式)、促进自噬、改变代谢或抑制动员逆转录转座子。由于具有多种潜在的癌症抑制机制,具体机制可能会因特定细胞环境或致癌事件而异。在所有人类癌症中,p53是最常见的突变基因,总体突变率约为50%。然而,突变的流行取决于癌症分期、癌症类型及其亚型。相比之下,p53突变存在于80%或更多难以治疗的癌症中,例如浆液性卵巢癌、肺鳞状细胞癌、肺小细胞癌、三阴性乳腺癌和鳞状食管癌。突变很少出现在儿童早期白血病、早期前列腺癌或睾丸癌中。与RAS的突变主要限于3个特定密码子不同,TP53突变可以在整个基因组中找到(尽管大多数在DNA结合域中发现)。
此外,并非所有突变在功能上都是等效的。因此,预计靶向突变p53可能比靶向突变RAS更困难。然而,一些p53突变,尤其是构象突变,会改变野生型蛋白质的构型。逆转这种突变的构象状态可能会导致野生型构象的恢复和野生型特性的恢复,包括抑制肿瘤发生的能力。使用基于细胞的筛选或计算机预测方法,已经确定了几种化合物,可以逆转p53的突变构象,从而恢复野生型类似特性。因此,至少一些抗突变药物的作用方式明显不同于通常通过直接中和它们的靶标起作用的大多数癌蛋白靶向剂的作用方式。两种突变p53药物目前正在进行临床试验:APR-246和COTI-2。Aprea Therapeutics开发的APR-246(也称为Eprenetapopt或PRIMA-1MET)是研究最广泛、临床研究进度最快的突变p53再激活化合物。为了介导其抗肿瘤作用,APR-246最初被转化为中间活性化合物,亚甲基奎宁酮(MQ),与突变体p53的DNA结合域中的特定游离硫醇基团(尤其是Cys277和Cys124)共价结合。这种结合将突变型p53转化为具有野生型p53活性的野生型样构象。与其重新激活突变p53的能力一致,APR-246已被证明可以在多种临床前肿瘤模型中抑制细胞增殖并促进细胞凋亡。去年12月28日,APR-246联合阿扎胞苷一线治疗骨髓增生异常综合征(MDS)的III期临床未达主要临床终点,是迄今为止最令人鼓舞的结果。FDA已经授予APR-246用于治疗表现出p53突变的骨髓增生异常综合征(MDS)患者快速通道和孤儿药资格。在欧洲,欧洲药品管理局已授予APR-246用于治疗卵巢癌孤儿药指定。另一种在临床试验中进行评估的突变p53再激活化合物是COTI-2。与APR-246类似,COTI-2已在各种体外和体内临床前模型中显示出抑制肿瘤细胞增殖并诱导细胞凋亡。目前,COTI-2与顺铂联合,正在对几种不同类型的晚期癌症进行Ib/IIa期试验。
MYC:任重道远
MYC蛋白主要用作转录调节因子,调节参与多种细胞过程的基因表达,例如细胞增殖、分化、凋亡、血管生成、代谢、DNA修复、蛋白质翻译、干细胞形成和免疫反应。MYC基因家族由3个成员组成,C-MYC、L-MYC和N-MYC,所有这些成员都编码含有基本螺旋-环-螺旋亮氨酸拉链(bHLHLZ)结构的核蛋白。MYC的形式,C-MYC是研究最广泛的。与RAS和TP53相比,MYC基因在癌症中很少发生突变。相反,癌症中主要的MYC遗传改变是失调(过度表达)和基因易位。基因易位主要见于淋巴瘤,尤其是伯基特淋巴瘤(其患病率接近100%),在多发性骨髓瘤、弥漫性大B细胞淋巴瘤和高级别滤泡性淋巴瘤(<10%)中较少见。MYC的过度表达可能是由于基因扩增、致癌基因信号增强或蛋白质降解减少所致。总体而言,C-MYC的扩增存在于21%的癌症中,最常见于卵巢癌(64%)、食道癌(45.3%)、肺癌(鳞状癌)(37.2%)和乳腺癌(30%)。相比之下,N-MYC和L-MYC在癌症中很少扩增(所有癌症<7%)。然而,在大约20-25%的神经母细胞瘤中发现了N-MYC的扩增,而L-MYC的扩增类似比例发生在小细胞肺癌中。
与RAS和p53相比,靶向MYC治疗癌症的研究进展明显缓慢得多。目前没有直接靶向抗MYC化合物进入到临床试验测试。在迄今为止研究的抗MYC化合物中,研究最深入且显然最接近临床试验的化合物是西班牙巴塞罗那瓦尔德希伯伦大学肿瘤研究所的研究者开发的OmoMYC。OmoMYC是一种90个氨基酸的肽/微蛋白,最初被设计为MYC的显性失活抑制剂。通过在亮氨酸拉链结构域中包含4个点突变,合成肽以模拟MYC的bHLHZ区域。引入这些突变是为了促进OmoMYC的同源二聚化,以及与MYC和MAX的异源二聚化。本质上,OmoMYC通过抑制MYC依赖性基因转录起作用。然而,OmoMYC仅阻断Myc反式激活活性,而不是其反式抑制活性。与其阻断MYC转录活性的能力一致,OmoMYC已在几种不同的临床前模型中显示出抗癌活性。OmoMYC现在正准备在临床试验中进行研究。为了使诸如OmoMYC之类的肽适合临床使用,必须克服一些困难,尤其是稳定性以防止给药后的蛋白水解降解。尽管目前似乎没有直接针对MYC的临床试验正在进行中,但已经进行了2项涉及针对癌基因(DCR-MYC)的siRNA的试验(I/II期)。然而,两者都被终止,但结果尚未公布。在靶向突变RAS、突变p53和MYC过表达用于癌症治疗方面正在取得真正的进展。尤其是KRAS的突破为“不可成药性”靶点研究带来了新的希望。尽管转录因子(TF)是癌症、自身免疫、糖尿病和心血管疾病等疾病的关键生物学参与者(表3)。然而,在核受体之外,由于显著的结构紊乱和缺乏明确的分子结合口袋,转录因子传统上被小分子配体认为是“不可成药性”。但随着化学生物学方法在配体发现和优化方面取得的重大进展,尤其是靶向蛋白质降解方法的出现,以及对关键转录因子效应基因的调控中发挥了作用关键作用认识越来越多,我们可能会进入包括癌症在内疗法开发的新时代。